题目内容
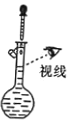
【题目】利用如图所示装置可制备LiOH,两电极区电解液分别为LiCl溶液和LiOH溶液。下列说法错误的是

A. B极区的电极反应式2H2O+2e-=H2↑+2OH-
B. A极的电势一定比B极的高
C. 实际电解过程中A极区pH减小
D. 若改为阴离子交换膜,则两极气体产物仍相同
【答案】B
【解析】
电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,在B中制备LiOH,Li+由A经过阳离子交换膜向B移动;A中为LiCl溶液,氯离子放电生成氯气,据此分析解答。
电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,在B中制备LiOH,Li+由A经过阳离子交换膜向B移动;A中为LiCl溶液,氯离子放电生成氯气,
A.通过以上分析知,B为阴极,水电离产生的氢离子得电子产生氢气,电极反应式为2H2O+2e-=H2↑+2OH-,选项A正确;
B. 根据以上分析,A极为阳极,发生氧化反应,电流由电势高的一极流向电势低的一极,电子移动方向相反,选项B不正确;
C. 实际电解过程中A极区氯离子放电生成氯气,氯气与水反应生成盐酸和次氯酸,溶液显酸性,pH减小,选项C正确;
D. 若改为阴离子交换膜,则允许氢氧根离子移动到A极区,A极产生氯气,B极产生氢气,两极气体产物仍相同,只是两极溶液的浓度有差异,选项D正确。
答案选B。

 53随堂测系列答案
53随堂测系列答案【题目】已知 2A(g)+B(g) 2C(g) ΔH= -a kJ·mol-1(a>0) ,在一个有催化剂、固定容积的容器中加入 2 mol A 和 1 mol B,在 500 ℃时充分反应达到平衡后C 的浓度为 x mol·L-1,放出热量bkJ。请回答下列问题:
(1) a_____b(填“>”、“=”或“ <”)。
(2)下表为不同温度下反应的平衡常数。由此可推知,表中 T1_____ T2(填“>”、“< ”或“ =”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.54×105 | 1.88×103 |
若在原来的容器中,只加入 2 mol C,500 ℃时充分反应达到平衡后,吸收热量 c kJ,则 C 的浓度_____x mol·L-1(填“>”、“=” 或“ <”),a、b、c 之间满足何种关系?_____(用代数式表示)
(3)在相同条件下要想得到 2a kJ 热量,加入各物质的物质的量可能是_____(填字母)。
A.4 mol A 和 2 mol B B.4 molA、2 mol B 和 2 mol C
C.4 mol A 和 4 mol B D.6 molA 和 4 mol B
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是_____(填字母)。
A.及时分离出C 气体 B.适当升高温度 C.增大 B 的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入 2 mol A 和 1 mol B,500 ℃时充分反应达到平衡后,放出热量 d kJ,则 d_____b(填“>”、“=” 或“ <”),理由是_____。
(6)在一定温度下,在一个容积不变的容器中通入 2 mol A 和 1 mol B 及适量固体催化剂,使反应达到平衡。保持同一反应温度,在相同容器中,将起始物质改为 4 mol A 和 2 mol B,则平衡时A 的转化率_____(填“不变”、“变大”、“变小”或“不能确定”)。