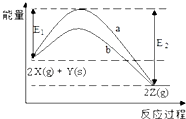
题目内容
【题目】为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用下图所示装置进行实验:
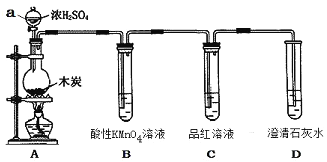
(1)仪器a的名称为:___________;在组装好上述实验装置后,在装入药品之前必需的实验操作是___________。
(2)写出A中发生反应的化学方程式_______________。
(3)装置B的作用是_______;该装置中发生的化学反应可说明SO2具有_______________性。
(4)已知SO2也可以使澄清的石灰水变浑浊,则能说明产物中一定存在CO2气体的实验现象为______________,____________。
【答案】 分液漏斗 检查装置的气密性 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 吸收SO2 还原性 品红溶液不褪色 澄清的石灰水变浑浊
CO2↑+2SO2↑+2H2O 吸收SO2 还原性 品红溶液不褪色 澄清的石灰水变浑浊
【解析】试题分析:本题考查碳与浓硫酸的反应,通过实验探究C与浓硫酸反应的产物中是否存在CO2。
(1)根据仪器的特点,仪器a的名称为分液漏斗。由于实验与气体有关,在组装好实验装置后,装入药品之前必需的实验操作是:检查装置的气密性。
(2)在装置A中C与浓硫酸共热反应生成CO2、SO2和H2O,反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(3)用澄清石灰水检验CO2,由于SO2也能使澄清石灰水变浑浊,所以检验CO2之前必须除尽SO2。装置B中酸性KMnO4用于除去SO2,B中的现象是紫红色溶液褪色,发生的反应为5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,该反应表明SO2具有还原性。
(4)装置C中品红溶液的作用是检验SO2是否除尽,能说明产物中一定存在CO2的实验现象是:品红溶液不褪色,澄清的石灰水变浑浊。

【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件. 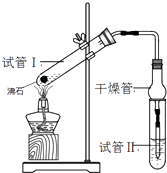
物质 | 沸点/°C | 密度/gcm﹣3 |
乙醇 | 78.0 | 0.79 |
乙酸 | 117.9 | 1.05 |
乙酸乙酯 | 77.5 | 0.90 |
异戊醇 | 131 | 0.8123 |
乙酸异戊酯 | 142 | 0.8670 |
实验步骤如下:
①配制反应混合液:2mL浓H2SO4、3mL乙醇、2mL乙酸
②按图连接实验装置并检验气密性
③分别在试管1、试管2中加入反应液
④用酒精灯微热3min,再加热使之微微沸腾3min
⑤分离提纯乙酸乙酯
(1)在试管1中加入物质分别是:(按着加入的先后顺序写出名称),乙醇过量的目的是:;
(2)该反应的平衡常数表达式K=;
(3)试管Ⅱ中所盛试剂为 , 欲将其物质分离使用的仪器为 , 在充分振荡的过程中,发生的反应为;
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 测得有机层的厚度/cm |
A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和mol/L;
②分析实验(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是;
(5)若利用该装置制备乙酸异戊酯,产物将主要在装置中的得到,那么产率会(“较高”或“偏低”).