题目内容
【题目】常温常压下,用电火花引爆 H2 和 Cl2 所组成的混合气体,反应停止后再恢复到原来的温度和压强, 测得气体体积与发生反应前恰好相等.则下列叙述合理的是( )
A. 与原混合气体中 H2 和 Cl2 的体积配比无关
B. 原混合气体中 H2 的体积一定大于 Cl2 的体积
C. 原混合气体中 H2 的体积一定小于 Cl2 的体积
D. 原混合气体中 H2 的体积恰好与 Cl2 的体积相等
【答案】A
【解析】根据化学反应方程式 H2+Cl2==2HCl,反应前是2mol气体,反应后也是2mol气体,所以不管用什么体积配比,发生反应的气体体积都没有变化,所以与原混合气体中H2和Cl2的体积配比无关。故A正确。

 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
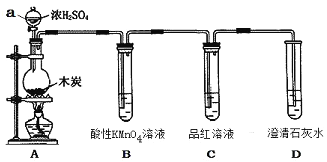
第三学期赢在暑假系列答案【题目】实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
化合物 | 相对分 | 密度 | 沸点/℃ | 溶解度 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
操作如下:
①在50mL圆底烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管(填“a”或“b”)端管口通入.
(2)进行分液操作时,使用的漏斗是(填选项).
(3)仪器A中乙酸和正丁醇制备乙酸正丁酯的化学方程为 .
(4)步骤①“不断分离除去反应生成的水”的目的是 .
(5)步骤②中用10% Na2CO3溶液洗涤有机层,该步操作的目的是
(6)乙酸正丁酯的产率为 .
【题目】一定量的CO2 通入体积为 50mL 的 NaOH 溶液中,为了测定应后溶液的成分,向其中滴加 1.0mol/L 的盐酸,加入盐酸的体积和生成 CO2的体积(标准状况下)的关系如图所示。

(1)OA 段发生反应的离子方程式为:_______________________________。
(2)溶液中溶质是:_____________,其物质的量之比为______________。
(3)原 NaOH 溶液的物质的量浓度为_____________。
(4)原 NaOH 溶液中通入 CO2 气体体积_________mL。
(5)当向 NaOH 溶液中通入少量 CO2时,溶液中的溶质是 NaOH 和 Na2CO3,设计如下实验证明该溶质的组成,请补充完整。
实验方案 | 实验现象 | 实验结论 |
取少量溶液于试管中,加入足量 BaCl2溶液 | ___________ | 说明溶液中含有 Na2CO3 |
___________ | ___________ | 说明溶液中含有 NaOH |