��Ŀ����
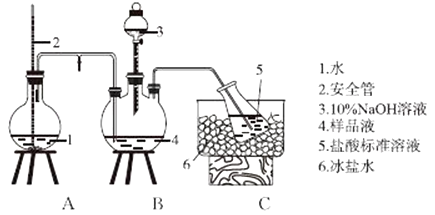
����Ŀ����֪����������һ����̼��Ѹ�ٷ������·�Ӧ��SO2+2CO![]() S+2CO2��ijͬѧ��������ͼ��ʾװ��̽��������Ӧ���ɵ���̬������ּг�����δ������
S+2CO2��ijͬѧ��������ͼ��ʾװ��̽��������Ӧ���ɵ���̬������ּг�����δ������
��������֪��CO���ܱ����Ը��������Һ������CuCl��������Һ������CO���ش��������⣺
��1������a��������_____________��װ��A�з����ķ�Ӧ�Ƿ�����������ԭ��Ӧ��________����ǡ� ��������
��2��װ��B��Ũ������ֳ���������________________��
��3���������Ʊ�¶�ڿ������ױ��ʣ��䷴Ӧ�Ļ�ѧ����ʽΪ___________��
��4��װ��C��D��E������ȥδ��Ӧ��SO2�����鷴Ӧ���ɵ�CO2��
��װ��D��Ʒ����Һ��������______________________________��
����ƽװ��C�з�Ӧ�����ӷ���ʽ��_____
SO2 + MnO4�� + H2O �� SO42�� + Mn2+ + H+
��������Һ�У������滻���Ը��������Һ����_________������ĸ��ţ���
A����ˮ B������NaHCO3��Һ C��Na2SO3��Һ
D. Fe2(SO4)3��Һ E��Na2CO3��Һ
����ͬѧ��Ϊ��ʡ��ȥװ��D��Ҳ�ܴﵽͬ����ʵ��Ŀ�ġ���ʱװ��C�й۲쵽������______��
���𰸡� Բ����ƿ �� ��ˮ�� 2Na2SO3+O2=2Na2SO4 �ж�SO2�ѱ���ȫ���� 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ BE ���������Һ���Ϻ�ɫ��dz(��û����ȫ��ɫ)
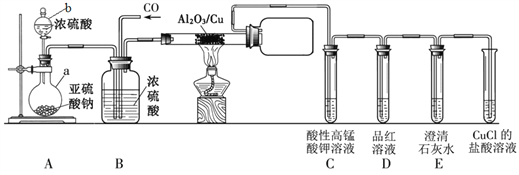
������������װ��ͼ��ʵ��Ŀ�ģ���װ��A��Na2SO3��ŨH2SO4��Ӧ�Ʊ�SO2��װ��B����Ũ��������H2O��g��������SO2��CO��ͬʱ��SO2��CO��ֻ�ϣ���Ӳ�ʲ�������SO2��CO������Ӧ�����ƿ�����ռ�S��װ��C������KMnO4���ڳ�ȥSO2��װ��D��Ʒ����Һ���ڼ���SO2�Ѿ�������װ��E�г���ʯ��ˮ���ڼ������CO2������������CO���ܱ�����KMnO4��Һ������CuCl��������Һ������CO����CuCl��������Һ����CO����ֹ��Ⱦ������
��1����������a�Ĺ����ص㣬����a��������Բ����ƿ��װ��A�з����ķ�ӦΪ��Na2SO3+H2SO4��Ũ��=Na2SO4+H2O+SO2������Ӧǰ��Ԫ�صĻ��ϼ�û�б仯���÷�Ӧ������������ԭ��Ӧ��
��2��װ��B��Ũ�������ڸ���SO2��CO��Ũ������ֳ��������ǣ���ˮ�ԡ�
��3���������Ʊ�¶�ڿ������ױ��ʣ��������Ʊ����������������������ƣ���Ӧ�Ļ�ѧ����ʽΪ2Na2SO3+O2=2Na2SO4��
��4��װ��C��D��E������ȥδ��Ӧ��SO2�����鷴Ӧ���ɵ�CO2������SO2Ҳ��ʹ����ʯ��ˮ����ǣ�װ��C������KMnO4��Һ��ȥSO2��װ��D��Ʒ����Һ����SO2�Ѿ�������װ��E�г���ʯ��ˮ����CO2��
��װ��D��Ʒ����Һ�������ǣ��ж�SO2�ѱ���ȫ�����������ǣ�Ʒ����Һ����ɫ��
��MnԪ�صĻ��ϼ���+7�۽���+2����1molMnO4-���뷴Ӧ�õ�5mol������SԪ�صĻ��ϼ���+4������+6����1molSO2���뷴Ӧʧȥ2mol���ӣ����ݵ�ʧ�����غ㡢ԭ���غ�͵���غ㣬װ��C�з�Ӧ�����ӷ���ʽΪ��5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+��
��A���ˮ������SO2�Ҳ�����CO2����ˮ������CO2��������ˮ�滻����KMnO4��Һ��B�����NaHCO3������SO2���������CO2����CO2�ļ��飬�����ñ���NaHCO3��Һ�滻����KMnO4��Һ��C�Na2SO3������SO2�Ҳ�����CO2��Na2SO3��Һ������CO2������Na2SO3��Һ�滻����KMnO4��Һ��D�Fe2��SO4��3��Һ������SO2�Ҳ�����CO2��Fe2��SO4��3��Һ������CO2������Fe2��SO4��3��Һ�滻����KMnO4��Һ��E�Na2CO3��Һ��������SO2����������CO2��������Na2CO3��Һ�滻����KMnO4��Һ�������滻����KMnO4��Һ����BE����ѡBE��
��ʡ��װ��DҲ�ܴﵽʵ��Ŀ�ģ�װ��C�е�����KMnO4��Һ���������ã���ȥSO2�����ж�SO2�Ѿ���������ʱװ��C�й۲쵽�������ǣ����������Һ���Ϻ�ɫ��dz����û����ȫ��ɫ����

 ��У����ϵ�д�
��У����ϵ�д�