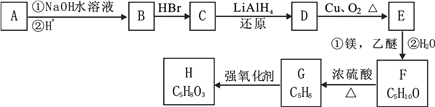
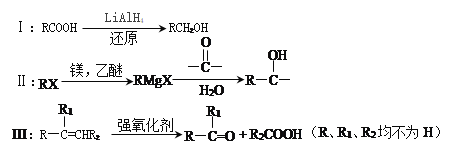
题目内容
【题目】把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)nZ(g)+2W(g).2min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.1mol/( Lmin),则n的值为( )
A.4
B.3
C.2
D.1
【答案】A
【解析】解:5min末生成0.2molW,则v(W)= ![]() =
= ![]() =0.05mol/(Lmin),速率之比等于其化学计量数之比,则2:n=0.05mol/(Lmin):0.1mol/(Lmin),解得n=4,
=0.05mol/(Lmin),速率之比等于其化学计量数之比,则2:n=0.05mol/(Lmin):0.1mol/(Lmin),解得n=4,
故选A.
【考点精析】本题主要考查了反应速率的定量表示方法的相关知识点,需要掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t才能正确解答此题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表如示。下列判断中正确的是
甲 | 乙 | 丙 | 丁 | ||
容器的体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
A. 甲中反应的平衡常数小于乙 B. 该温度下,该反应的平衡常数K为400
C. SO2的平衡转化率:α1>α2=α3 D. 容器中SO3的物质的量浓度:丙=丁<甲