题目内容
8.制取氨气并完成喷泉实验(图中夹持装置均已略去)(1)写出实验室制取氨气化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O
(2)收集氨气应使用向下排空气法,要得到干燥的氨气可选用碱石灰做干燥剂
(3)如图所示,实验室常用下列装置和选用的试剂制取NH3,其中正确的是BD(填序号)
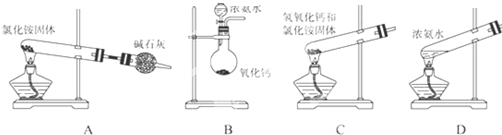 .
.(4)用如图甲所示装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是打开止水夹,挤出胶头滴管中的水.该实验的原理是氨气极易溶于水,致使烧瓶内气体压强迅速减小当水充满整个烧瓶后,烧瓶内氨水(设此氨水密度为1g/mol)的浓度为0.045mol/L

(5)某同学有一个创新的想法,想更换一下烧瓶中的气体,换一个胶头滴管和烧杯内的液体,也可以完成喷泉实验,果然得到了美丽的喷泉,那么下面组合中不可能是该同学设计的是B
A.HCl和水 B.氧气和水 C.二氧化碳和NaOH溶液 D.二氧化氮和水.
分析 (1)实验室用NH4Cl和Ca(OH)2加热制取NH3;
(2)氨气易溶于水,所以不能采用排水法收集,氨气密度小于空气且常温下不和氧气反应,可以采用排空气法收集;氨气属于碱性气体,应该用碱性物质干燥;
(3)A.氯化铵受热分解生成氨气和氯化氢,冷却又生成氯化铵,不能制取氨气;
B.浓氨水可以制取氨气;
C.氢氧化钙与氯化铵反应生成水,试管应向下倾斜;
D.加热浓氨水可以制取氨气;
(4)引发水上喷的操作是打开止水夹,挤出胶头滴管中的水;只要气体极易溶于这种液体就能产生喷泉实验;设烧瓶体积为VL,则n(NH3)=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,溶液体积为VL,则氨水物质的量浓度C=$\frac{n}{V}$;
(5)只要气体极易溶于这种溶液就能产生喷泉实验.
解答 解:(1)实验室用NH4Cl和Ca(OH)2加热制取NH3,反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
(2)氨气易溶于水,所以不能采用排水法收集,氨气密度小于空气且常温下不和氧气反应,可以采用向下排空气法收集;氨气属于碱性气体,应该用碱性物质干燥,如碱石灰,故答案为:向下排空气法;碱石灰;
(3)A.氯化铵受热分解生成氨气和氯化氢,冷却又生成氯化铵,不能制取氨气,故错误;
B.氨水具有挥发性,氧化钙和水反应放出的热促进浓氨水分解,所以该装置可以制取氨气,故正确;
C.氢氧化钙与氯化铵反应生成水,试管应向下倾斜,否则易炸裂试管,故错误;
D.氨水具有挥发性,加热浓氨水可以制取氨气,故正确;
故选BD;
(4)引发水上喷的操作是打开止水夹,挤出胶头滴管中的水,氨气极易溶于水而产生压强差,从而形成喷泉实验;
只要气体极易溶于这种液体就能产生喷泉实验,氨气极易溶于水,致使烧瓶内气体压强迅速减小从而产生喷泉实验;
设烧瓶体积为VL,则n(NH3)=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,溶液体积为VL,则氨水物质的量浓度C=$\frac{n}{V}$=$\frac{\frac{V}{22.4}}{V}$mol/L=0.045mol/L,
故答案为:打开止水夹,挤出胶头滴管中的水;氨气极易溶于水,致使烧瓶内气体压强迅速减小;0.045mol/L;
(5)只要气体极易溶于这种溶液就能产生喷泉实验,
A.HCl极易溶于水,所以可以形成喷泉实验,故不选;
B.氧气不易溶于水,所以不能形成喷泉实验,故选;
C.二氧化碳极易溶于NaOH溶液,所以可以形成喷泉实验,故不选;
D.二氧化氮极易和水反应生成硝酸而NO,所以可以形成喷泉实验,故不选;
故选B.
点评 本题考查氨气的实验室制法、喷泉实验等知识点,明确实验原理是解本题关键,熟练掌握氨气的制取、干燥和收集方法,知道喷泉实验形成条件,题目难度不大.

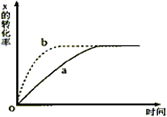 如图曲线a表示放热反应2X(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,不可采取的措施是( )
如图曲线a表示放热反应2X(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,不可采取的措施是( )| A. | 升高温度 | B. | X的投入量增加 | C. | 加催化剂 | D. | 减小容器体积 |
| A. | 浓硝酸和稀硝酸都具有氧化性 | B. | 铜与硝酸的反应属于置换反应 | ||
| C. | 金属与硝酸反应不产生氢气 | D. | 可用铁或铝制品盛装浓硝酸 |
| A. | MgCl2和H2O | B. | Mg(OH)2、HCl和H2O | C. | Mg、Cl2和H2O | D. | MgO、HCl和H2O |
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4溶液、石蕊试液褪色 | |
| B. | 能使品红褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | 盐酸能使滴有酚酞的NaOH溶液褪色,所以盐酸也有漂白性 |
| A. | 任何物质燃烧都必须有氧气参加 | |
| B. | 氢气在氯气中燃烧发出淡蓝色火焰,并在空气中产生大量白雾 | |
| C. | 饱和氯水在光照下有气泡产生,该气体为氯气 | |
| D. | 长久放置的氯水将失去漂白性 |
| A. | Na、Cl2、Br2 | B. | H2、N2O4、Cl2 | C. | I-、F2、H2O | D. | SO2、H+、HCl |
| A. | 塑料 | B. | 纤维 | C. | 橡胶 | D. | 生物材料 |