题目内容
为测定碳酸钙纯度(设含杂质SiO2),同学们设计了如下几个实验方案,请回答每个方案中的问题.
[方案I]
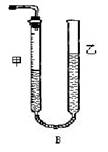
(1)称取碳酸钙样品 M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL.
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II]
(1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
(3)取溶解后的溶液
mL,用c′mol/L NaOH溶液滴定,恰好用去V′mL.
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外) .
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号).
A.需要 B.不需要 C.均可
[方案III]
(1)称取碳酸钙样品 M g;
(2)把样品高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g.
问题1:为什么要煅烧至1000℃且“直至质量不再改变”? ;
问题2:本方案中的“冷却”应如何操作 .
[方案IV]
(1)称取碳酸钙样品 M g;
(2)加入足量c mol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g.
问题1:此方案中不需要的数据是 (填选项编号).
A.c、V B.c′、V′C. M′D. M
问题2:为减少实验误差,必要的操作是 (填选项编号).
A.精确测定Na2CO3溶液体积V′mL
B.精确配制浓度c′mol/L Na2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤液也应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钙纯度
将 (偏高、偏低、无影响).
综上所述,你认为4个方案中,最好的方案是 ,其它方案的缺点分别是:
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案 ; .
方案 ; .
[方案I]
(1)称取碳酸钙样品 M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL.
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会
[方案II]
(1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
(3)取溶解后的溶液
| V | 10 |
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定
A.需要 B.不需要 C.均可
[方案III]
(1)称取碳酸钙样品 M g;
(2)把样品高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g.
问题1:为什么要煅烧至1000℃且“直至质量不再改变”?
问题2:本方案中的“冷却”应如何操作
[方案IV]
(1)称取碳酸钙样品 M g;
(2)加入足量c mol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g.
问题1:此方案中不需要的数据是
A.c、V B.c′、V′C. M′D. M
问题2:为减少实验误差,必要的操作是
A.精确测定Na2CO3溶液体积V′mL
B.精确配制浓度c′mol/L Na2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤液也应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钙纯度
将
综上所述,你认为4个方案中,最好的方案是
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案
方案
分析:方案Ⅰ、如果称量样品时,砝码底部有一处未被实验者发现的残缺,依据天平称量原理分析,称量出物质的质量减小;
方案Ⅱ、问题1、依据实验步骤分析所需仪器,需要取用固体试剂,天平称量,溶解后剩余盐酸用氢氧化钠溶液滴定需要滴定管,锥形瓶等;
问题2、酸碱中和反应终点是利用指示剂变色确定,滴定终点为中性,不能溶解二氧化硅,二氧化硅不与盐酸反应,过滤时会引起盐酸损失影响滴定结果;
方案Ⅲ、问题1、煅烧至1000℃且“直至质量不再改变是让样品中的碳酸钙全部分解;
问题2、冷却操作是在空气中冷却后最后放在干燥器中冷却;
方案Ⅳ、问题1,加入过量盐酸,碳酸钙全部溶解为氯化钙溶液,加入过量碳酸钠会沉淀钙离子为碳酸钙沉淀,所以最后洗涤干燥得到的沉淀质量即为样品中碳酸钙质量,计算得到质量分数;
问题2、减小误差主要是盐酸溶解后的钙离子全部转移后沉淀出;
问题3、沉淀不洗涤,沉淀表面会沾有气体杂质,称量得到沉淀质量增大,含量偏高;
分析判断方案Ⅱ测定结果更准确;
方案Ⅰ中气体体积难于准确测定,方案Ⅲ,在实验室中难于提供1000°C的温度;方案Ⅳ称量操作复杂,易造成误差;
方案Ⅱ、问题1、依据实验步骤分析所需仪器,需要取用固体试剂,天平称量,溶解后剩余盐酸用氢氧化钠溶液滴定需要滴定管,锥形瓶等;
问题2、酸碱中和反应终点是利用指示剂变色确定,滴定终点为中性,不能溶解二氧化硅,二氧化硅不与盐酸反应,过滤时会引起盐酸损失影响滴定结果;
方案Ⅲ、问题1、煅烧至1000℃且“直至质量不再改变是让样品中的碳酸钙全部分解;
问题2、冷却操作是在空气中冷却后最后放在干燥器中冷却;
方案Ⅳ、问题1,加入过量盐酸,碳酸钙全部溶解为氯化钙溶液,加入过量碳酸钠会沉淀钙离子为碳酸钙沉淀,所以最后洗涤干燥得到的沉淀质量即为样品中碳酸钙质量,计算得到质量分数;
问题2、减小误差主要是盐酸溶解后的钙离子全部转移后沉淀出;
问题3、沉淀不洗涤,沉淀表面会沾有气体杂质,称量得到沉淀质量增大,含量偏高;
分析判断方案Ⅱ测定结果更准确;
方案Ⅰ中气体体积难于准确测定,方案Ⅲ,在实验室中难于提供1000°C的温度;方案Ⅳ称量操作复杂,易造成误差;
解答:解:方案Ⅰ、如果称量样品时,砝码底部有一处未被实验者发现的残缺,依据天平称量原理分析,砝码质量减小,称量出物质的质量减小,所以那么测定的碳酸钙的纯度会偏低;
故答案为:偏低;
方案Ⅱ、问题1、依据实验步骤分析所需仪器,需要取用固体试剂,天平称量,溶解后剩余盐酸用氢氧化钠溶液滴定需要滴定管,锥形瓶等;
故答案为:托盘天平(砝码)、药匙、酸式和碱式滴定管、锥形瓶;
问题2、酸碱中和反应终点是利用指示剂变色确定,滴定终点为中性,不能溶解二氧化硅,二氧化硅不与盐酸反应,过滤时会引起盐酸损失影响滴定结果;
故答案为:B;
方案Ⅲ、问题1、煅烧至1000℃且“直至质量不再改变是让样品中的碳酸钙全部分解;
故答案为:保证CaCO3完全分解;
问题2、冷却操作是在空气中冷却后最后放在干燥器中冷却,避免吸收空气中的水蒸气;
故答案为:先在空气中适当冷却后再放进干燥器中冷却;
方案Ⅳ、问题1,加入过量盐酸,碳酸钙全部溶解为氯化钙溶液,加入过量碳酸钠会沉淀钙离子为碳酸钙沉淀,所以最后洗涤干燥得到的沉淀质量即为样品中碳酸钙质量,计算得到质量分数,需要数据是称取碳酸钙样品 M g,将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g;
故答案为:AB.
问题2、为减少实验误差,必要的操作是,减小误差主要是盐酸溶解后的钙离子全部转移后沉淀出;
A.精确测定Na2CO3溶液体积V′mL,利用的是沉淀质量,碳酸钠溶液过量沉淀钙离子完全即可,故A不符合;
B.精确配制浓度c′mol/L Na2CO3溶液,利用的是沉淀质量,碳酸钠溶液过量沉淀钙离子完全即可,与碳酸钠浓度精确度无关,故B不符合;
C.将步骤(3)所得沉淀洗涤,洗涤液也应并入(4)中,保证溶解的钙离子重新全部沉淀出来,故C符合;
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用,对减小误差无影响,故D不符合;
故答案为:C.
问题3、沉淀不洗涤,沉淀表面会沾有气体杂质,称量得到沉淀质量增大,含量偏高;
故答案为:偏高;
分析判断方案Ⅱ测定结果更准确;
故答案为:Ⅱ;
方案Ⅰ中气体体积难于准确测定,实验操作复杂,不易准确测定;
方案Ⅲ,在实验室中难于提供1000°C的温度,实验装置和仪器,及其反应条件难于达到;
方案Ⅳ称量操作复杂,易造成误差;
故答案为:方案Ⅰ:气体体积难以准确测量;方案Ⅲ:实验室难以提供1000℃的高温;
故答案为:偏低;
方案Ⅱ、问题1、依据实验步骤分析所需仪器,需要取用固体试剂,天平称量,溶解后剩余盐酸用氢氧化钠溶液滴定需要滴定管,锥形瓶等;
故答案为:托盘天平(砝码)、药匙、酸式和碱式滴定管、锥形瓶;
问题2、酸碱中和反应终点是利用指示剂变色确定,滴定终点为中性,不能溶解二氧化硅,二氧化硅不与盐酸反应,过滤时会引起盐酸损失影响滴定结果;
故答案为:B;
方案Ⅲ、问题1、煅烧至1000℃且“直至质量不再改变是让样品中的碳酸钙全部分解;
故答案为:保证CaCO3完全分解;
问题2、冷却操作是在空气中冷却后最后放在干燥器中冷却,避免吸收空气中的水蒸气;
故答案为:先在空气中适当冷却后再放进干燥器中冷却;
方案Ⅳ、问题1,加入过量盐酸,碳酸钙全部溶解为氯化钙溶液,加入过量碳酸钠会沉淀钙离子为碳酸钙沉淀,所以最后洗涤干燥得到的沉淀质量即为样品中碳酸钙质量,计算得到质量分数,需要数据是称取碳酸钙样品 M g,将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g;
故答案为:AB.
问题2、为减少实验误差,必要的操作是,减小误差主要是盐酸溶解后的钙离子全部转移后沉淀出;
A.精确测定Na2CO3溶液体积V′mL,利用的是沉淀质量,碳酸钠溶液过量沉淀钙离子完全即可,故A不符合;
B.精确配制浓度c′mol/L Na2CO3溶液,利用的是沉淀质量,碳酸钠溶液过量沉淀钙离子完全即可,与碳酸钠浓度精确度无关,故B不符合;
C.将步骤(3)所得沉淀洗涤,洗涤液也应并入(4)中,保证溶解的钙离子重新全部沉淀出来,故C符合;
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用,对减小误差无影响,故D不符合;
故答案为:C.
问题3、沉淀不洗涤,沉淀表面会沾有气体杂质,称量得到沉淀质量增大,含量偏高;
故答案为:偏高;
分析判断方案Ⅱ测定结果更准确;
故答案为:Ⅱ;
方案Ⅰ中气体体积难于准确测定,实验操作复杂,不易准确测定;
方案Ⅲ,在实验室中难于提供1000°C的温度,实验装置和仪器,及其反应条件难于达到;
方案Ⅳ称量操作复杂,易造成误差;
故答案为:方案Ⅰ:气体体积难以准确测量;方案Ⅲ:实验室难以提供1000℃的高温;
点评:不同考查了实验探究物质存在和性质的实验设计和分析判断,注意实验过程中的数据应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
 为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
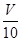 mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。