题目内容
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.
[方案Ⅰ](1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸V mL(过量)溶解样品;
(3)取溶解后的溶液
mL,用c′mol/L NaOH溶液滴定,恰好用去V′mL.
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外) ;
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号);
A.需要 B.不需要 C.均可
问题3:碳酸钙纯度计算公式 .
[方案Ⅱ](1)称取碳酸钙样品 m g;
(2)加入足量c mol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为m1g.
问题1:此方案中不需要的数据是 (填选项编号);
A.c、V B.c′、V′C.m1 D. m
问题2:为减少实验误差,必要的操作是 (填选项编号);
A.精确测定Na2CO3溶液体积V′mL
B.精确配制浓度c′mol/LNa2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤液应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量m2 g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钙纯度将 (偏高、偏低、无影响).
上述两个方案中,较好的方案是 ,另一方案的缺点是 .
[方案Ⅰ](1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸V mL(过量)溶解样品;
(3)取溶解后的溶液
| V | 10 |
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定
A.需要 B.不需要 C.均可
问题3:碳酸钙纯度计算公式
[方案Ⅱ](1)称取碳酸钙样品 m g;
(2)加入足量c mol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为m1g.
问题1:此方案中不需要的数据是
A.c、V B.c′、V′C.m1 D. m
问题2:为减少实验误差,必要的操作是
A.精确测定Na2CO3溶液体积V′mL
B.精确配制浓度c′mol/LNa2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤液应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量m2 g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钙纯度将
上述两个方案中,较好的方案是
分析:[方案Ⅰ]问题1:依据实验步骤分析所需仪器,需要取用固体试剂,天平称量,溶解后剩余盐酸用氢氧化钠溶液滴定需要滴定管,锥形瓶等;
问题2:酸碱中和反应滴定终点为中性,不会溶解二氧化硅,二氧化硅也不与盐酸反应,过滤会引起盐酸损失影响滴定结果;
问题3:根据酸碱中和滴定中氢氧化钠消耗的氯化氢计算出碳酸钙反应消耗的氯化氢,再根据碳酸钙与氯化氢反应的关系式计算出碳酸钙的物质的量、质量及样品中碳酸钙的质量分数;
[方案Ⅱ]问题1:加入过量盐酸,碳酸钙全部溶解为氯化钙溶液,加入过量碳酸钠会沉淀钙离子为碳酸钙沉淀,所以最后洗涤干燥得到的沉淀质量即为样品中碳酸钙质量,计算得到质量分数;
问题2:减小误差主要是盐酸溶解后的钙离子全部转移后沉淀出;
问题3:沉淀表面会沾有杂质,沉淀不洗涤,称量得到沉淀质量增大,含量偏高;分析判断可知方案Ⅰ测定结果更准确;方案Ⅱ称量操作复杂,易造成误差.
问题2:酸碱中和反应滴定终点为中性,不会溶解二氧化硅,二氧化硅也不与盐酸反应,过滤会引起盐酸损失影响滴定结果;
问题3:根据酸碱中和滴定中氢氧化钠消耗的氯化氢计算出碳酸钙反应消耗的氯化氢,再根据碳酸钙与氯化氢反应的关系式计算出碳酸钙的物质的量、质量及样品中碳酸钙的质量分数;
[方案Ⅱ]问题1:加入过量盐酸,碳酸钙全部溶解为氯化钙溶液,加入过量碳酸钠会沉淀钙离子为碳酸钙沉淀,所以最后洗涤干燥得到的沉淀质量即为样品中碳酸钙质量,计算得到质量分数;
问题2:减小误差主要是盐酸溶解后的钙离子全部转移后沉淀出;
问题3:沉淀表面会沾有杂质,沉淀不洗涤,称量得到沉淀质量增大,含量偏高;分析判断可知方案Ⅰ测定结果更准确;方案Ⅱ称量操作复杂,易造成误差.
解答:解:方案Ⅰ问题1:依据实验步骤分析所需仪器,需要取用固体试剂,天平称量,溶解后剩余盐酸用氢氧化钠溶液滴定需要滴定管、锥形瓶等,所以使用的仪器为:酸式滴定管(或移液管)、碱式滴定管、锥形瓶、托盘天平、药匙,
故答案为:酸式滴定管(或移液管)、碱式滴定管、锥形瓶、托盘天平、药匙;
问题2:酸碱中和反应终点是利用指示剂变色确定,滴定终点为中性,不能溶解二氧化硅,二氧化硅不与盐酸反应,过滤时会引起盐酸损失影响滴定结果,
故答案为:B;
问题3:碳酸钙消耗的氯化氢的物质的量为:c mol×V×10-3mol/L-10c′mol×V′×10-3mol/L=(cV-10c′V′)×10-3mol,
碳酸钙与氯化氢反应的关系式为:CaCO3~2HCl,碳酸钙的物质的量为:
×(cV-10c′V′)×10-3mol,
所以样品中碳酸钙的质量分数为:
×100%=
×100%,
故答案为:
×100%;
[方案Ⅱ]问题1:加入过量盐酸,碳酸钙全部溶解为氯化钙溶液,加入过量碳酸钠会沉淀钙离子为碳酸钙沉淀,所以最后洗涤干燥得到的沉淀质量即为样品中碳酸钙质量,计算得到质量分数,需要数据是称取碳酸钙样品m g,将步骤(4)中的沉淀滤出、洗涤、干燥、称重为m1g,所以不需要的是:A.c、V 和B.c′、V′,
故答案为:AB;
问题2:为减少实验误差,必要的操作是,减小误差主要是盐酸溶解后的钙离子全部转移后沉淀出,
A.精确测定Na2CO3溶液体积V′mL,利用的是沉淀质量,碳酸钠溶液过量沉淀钙离子完全即可,故A错误;
B.精确配制浓度c′mol/L Na2CO3溶液,利用的是沉淀质量,碳酸钠溶液过量沉淀钙离子完全即可,与碳酸钠浓度精确度无关,故B错误;
C.将步骤(3)所得沉淀洗涤,洗涤液也应并入(4)中,保证溶解的钙离子重新全部沉淀出来,故C正确;
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用,对减小误差无影响,故D错误;
故答案为:C.
问题3:若沉淀不洗涤,沉淀表面会沾有杂质,则称量得到沉淀质量会增大,测定的样品中碳酸钙的含量偏高;通过对比题中两个方案可知,方案Ⅰ测定结果更准确;而方案Ⅱ中,沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差,
故答案为:偏高;Ⅰ;沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差.
故答案为:酸式滴定管(或移液管)、碱式滴定管、锥形瓶、托盘天平、药匙;
问题2:酸碱中和反应终点是利用指示剂变色确定,滴定终点为中性,不能溶解二氧化硅,二氧化硅不与盐酸反应,过滤时会引起盐酸损失影响滴定结果,
故答案为:B;
问题3:碳酸钙消耗的氯化氢的物质的量为:c mol×V×10-3mol/L-10c′mol×V′×10-3mol/L=(cV-10c′V′)×10-3mol,
碳酸钙与氯化氢反应的关系式为:CaCO3~2HCl,碳酸钙的物质的量为:
| 1 |
| 2 |
所以样品中碳酸钙的质量分数为:
100×
| ||
| M |
| 100(cV-10c′V′)×10-3 |
| 2M |
故答案为:
| 100(cV-10c′V′)×10-3 |
| 2M |
[方案Ⅱ]问题1:加入过量盐酸,碳酸钙全部溶解为氯化钙溶液,加入过量碳酸钠会沉淀钙离子为碳酸钙沉淀,所以最后洗涤干燥得到的沉淀质量即为样品中碳酸钙质量,计算得到质量分数,需要数据是称取碳酸钙样品m g,将步骤(4)中的沉淀滤出、洗涤、干燥、称重为m1g,所以不需要的是:A.c、V 和B.c′、V′,
故答案为:AB;
问题2:为减少实验误差,必要的操作是,减小误差主要是盐酸溶解后的钙离子全部转移后沉淀出,
A.精确测定Na2CO3溶液体积V′mL,利用的是沉淀质量,碳酸钠溶液过量沉淀钙离子完全即可,故A错误;
B.精确配制浓度c′mol/L Na2CO3溶液,利用的是沉淀质量,碳酸钠溶液过量沉淀钙离子完全即可,与碳酸钠浓度精确度无关,故B错误;
C.将步骤(3)所得沉淀洗涤,洗涤液也应并入(4)中,保证溶解的钙离子重新全部沉淀出来,故C正确;
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用,对减小误差无影响,故D错误;
故答案为:C.
问题3:若沉淀不洗涤,沉淀表面会沾有杂质,则称量得到沉淀质量会增大,测定的样品中碳酸钙的含量偏高;通过对比题中两个方案可知,方案Ⅰ测定结果更准确;而方案Ⅱ中,沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差,
故答案为:偏高;Ⅰ;沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差.
点评:本题考查了探究碳酸钙样品的含量、性质实验方案的设计与评价,题目难度中等,注意掌握实验过程中的数据分析与应用方法,明确评价实验方案的原则.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
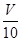 mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。