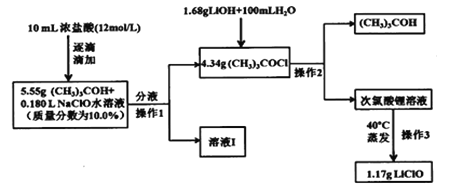
题目内容
【题目】Ⅰ.把在空气中久置的铝片 5.4g 投入盛有 500mL0.5molL-1 盐酸溶液的烧杯中该铝片与盐酸反应产生氢气的速率与反应时间可用如图所示的坐标曲线来表示,回答下列问题:

(1)曲线由 0→a 段不产生氢气的原因______, 用离子方程式表示为______;
(2)曲线由 b→c 段产生氢气的速率增加较快的主要原因______。
(3)向溶液中加入下列物质,能加快上述化学反应速率的是______。
A 蒸馏水 B 改用铝粉 C 饱和氯化钠溶液 D 浓盐酸 E 少量硫酸铜溶液.
Ⅱ.在 2 L 密闭容器中,800 ℃时反应 2NO+O2![]() 2NO2 体系中,n(NO)随时间的变化如下表:
2NO2 体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(4)如图表示各物质浓度的变化曲线,B 点处,v(正)_______v(逆),(用“大于”“小于”或“等于”填空)。

(5)能说明该反应已经达到平衡状态的是______。
a 容器内压强保持不变 b v(NO)=2v(O2)
c 容器内的密度保持不变 d 2v逆(NO2)=v正(O2)
【答案】铝片表面有氧化铝,盐酸首先和与表面的氧化铝反应 Al2O3+6H+=2Al3++3H2O 铝和盐酸反应放出的热量使溶液温度升高而加快反应速率 BDE 大于 a
【解析】
Ⅰ(1)铝片表面有氧化铝,盐酸首先和与表面的氧化铝反应,不产生氢气,所以开始没有气体产生,反应的离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:铝片表面有氧化铝,盐酸首先和与表面的氧化铝反应;Al2O3+6H+=2Al3++3H2O;
(2)随着反应的进行,盐酸的浓度减小,反应放热,温度升高,b→c段反应速率加快,说明是铝和盐酸反应放出的热量使溶液温度升高而加快反应速率,故答案为:铝和盐酸反应放出的热量使溶液温度升高而加快反应速率;
(3)A.加入蒸馏水,盐酸浓度降低,反应速率降低,A不选;
B.改用铝粉,增大了接触面积,化学反应速率加快,B选;
C.加入饱和的氯化钠溶液相当于加水,盐酸浓度降低,反应速率降低,C不选;
D.加入浓盐酸,盐酸的浓度增大,化学反应速率加快,D选;
E.少量的硫酸铜溶液可与Al形成原电池,加快化学反应速率,E选;
综上所述,BDE符合题意,故答案为:BDE;
Ⅱ(4)根据图像分析可知,B点反应时间不到3s,根据表中数据可知此时反应还没有达到平衡状态,反应向正反应方向进行,则v(正)>v(逆),故答案为:大于;
(5)a.因为反应前后气体分子数不等,所以平衡前容器内压强始终发生改变,当压强不变时,反应达平衡状态,a符合题意;
b.不管反应进行到什么程度,总有v(NO2)=2v(O2),所以不一定达平衡状态,b不符合题意;
c.容器内气体的质量不变,容器的体积不变,所以容器内密度保持不变,所以当密度不变时,反应不一定达平衡状态,c不符合题意;
d.2v逆(NO2)=v正(O2)表示反应方向相反,但数值之比不等于化学计量数之比,不能判断此时反应达平衡状态,d不符合题意;
故答案为:a。

【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
现利用如图装置制备SOCl2。

请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为___(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式);请设计实验验证装置C中生成的盐中含有SO42-:____。