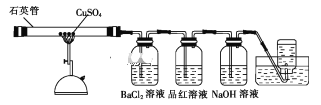
题目内容
【题目】某兴趣小组用莫尔盐[化学式为(NH4)xFe(SO4)2·6H2O(Fe为+2价)]测定KMnO4溶液的物质的量浓度的过程如下:
①称取19.6g莫尔盐配成100 mL溶液。
②量取10.00 mL KMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积为20.00 mL。所发生反应的离子方程式如下:H++Fe2++MnO4-![]() Fe3++Mn2++H2O(未配平)
Fe3++Mn2++H2O(未配平)
(1)(NH4)xFe(SO4)2·6H2O中x=____,溶液中c(Fe2+)=___mol·L-1。
(2)第①步实验中所需的玻璃仪器除量筒、烧杯、胶头滴管外,还有___。
(3)由第②步实验的反应可知还原性:Fe2+___(填“>”或“<”)Mn2+。
(4)计算KMnO4溶液的物质的量浓度,写出计算过程。_____
【答案】2 0.5 100mL容量瓶,玻璃棒 > n(Fe2+)=0.5 mol·L-1×20.00 mL×10-3L·mL-1=0.01 mol
根据配平后离子反应,可得关系式:5Fe2+~MnO4-
n(KMnO4)=0.01 mol÷5=0.002 mol
c(KMnO4)=0.002 mol÷10 mL×103 mL·L-1=0.2 mol·L-1
【解析】
(1)(NH4)xFe(SO4)2·6H2O中Fe的化合价为+2价,SO42-的化合价为-2价,NH4+的化合价为+1价,根据化合物的化合价的代数和为0可知:(+1)×x+(+2)+(-2)×2=0,解得x=2;溶液中n[(NH4)xFe(SO4)2·6H2O]=![]() =
=![]() =0.05mol,
=0.05mol,
则c(Fe2+)=c[(NH4)xFe(SO4)2·6H2O]=![]() =
=![]() =0.5mol/L,故答案为:2,0.5。
=0.5mol/L,故答案为:2,0.5。
(2)配制100mL的莫尔盐溶液,所需要的玻璃仪器有量筒、烧杯、胶头滴管、100mL容量瓶、玻璃棒,故答案为:100mL容量瓶,玻璃棒。
(3)反应H++Fe2++MnO4-![]() Fe3++Mn2++H2O中,Fe2+中Fe元素的化合价由+2价升高为+3价,化合价升高被氧化,作还原剂,所以Fe2+是还原剂,MnO4-中Mn元素的化合价由+7价降低为-2价,化合价降低,被还原,作氧化剂,得到还原产物,所以Mn2+是还原产物,根据氧化还原反应中还原剂的还原性大于还原产物的还原性,所以还原性Fe2+>Mn2+,故答案为:>。
Fe3++Mn2++H2O中,Fe2+中Fe元素的化合价由+2价升高为+3价,化合价升高被氧化,作还原剂,所以Fe2+是还原剂,MnO4-中Mn元素的化合价由+7价降低为-2价,化合价降低,被还原,作氧化剂,得到还原产物,所以Mn2+是还原产物,根据氧化还原反应中还原剂的还原性大于还原产物的还原性,所以还原性Fe2+>Mn2+,故答案为:>。
(4)反应H++Fe2++MnO4-![]() Fe3++Mn2++H2O中,Fe2+中Fe元素的化合价由+2价升高为+3价,失去1个电子,MnO4-中Mn元素的化合价由+7价降低为-2价,得到5个电子,根据电荷守恒和质量守恒配平方程式为8H++5Fe2++MnO4-=5Fe3++Mn2++4H2O,n(Fe2+)=0.5mol·L-1×20.00mL×10-3L·mL-1=0.01mol,根据配平后离子反应,可得关系式:5Fe2+~MnO4-,n(KMnO4)=0.01 mol÷5=0.002mol,c(KMnO4)=0.002 mol÷10 mL×103 mL·L-1=0.2mol·L-1,故答案为:. n(Fe2+)=0.5mol·L-1×20.00 mL×10-3L·mL-1=0.01mol,根据配平后离子反应,可得关系式:5Fe2+~MnO4-,n(KMnO4)=0.01 mol÷5=0.002mol,c(KMnO4)=0.002 mol÷10 mL×103 mL·L-1=0.2mol·L-1。
Fe3++Mn2++H2O中,Fe2+中Fe元素的化合价由+2价升高为+3价,失去1个电子,MnO4-中Mn元素的化合价由+7价降低为-2价,得到5个电子,根据电荷守恒和质量守恒配平方程式为8H++5Fe2++MnO4-=5Fe3++Mn2++4H2O,n(Fe2+)=0.5mol·L-1×20.00mL×10-3L·mL-1=0.01mol,根据配平后离子反应,可得关系式:5Fe2+~MnO4-,n(KMnO4)=0.01 mol÷5=0.002mol,c(KMnO4)=0.002 mol÷10 mL×103 mL·L-1=0.2mol·L-1,故答案为:. n(Fe2+)=0.5mol·L-1×20.00 mL×10-3L·mL-1=0.01mol,根据配平后离子反应,可得关系式:5Fe2+~MnO4-,n(KMnO4)=0.01 mol÷5=0.002mol,c(KMnO4)=0.002 mol÷10 mL×103 mL·L-1=0.2mol·L-1。

【题目】甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 平衡 常数 | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 | T1 | 2.0 | 4.0 | 3.2 | K1 |
乙 | 1 | T2 | 1.0 | 2.0 | 1.2 | K2 |
下列说法正确的是( )
A. K1=12.8
B. T1<T2
C. T1℃时向甲容器中再充入0.1 mol H2O(g),则平衡正向移动,CO2(g)的体积分数增大
D. 若在T2温度下,向2 L密闭容器中充入1.0 mol CO2和2.0 mol H2,达平衡时,CO2的转化率小于40%