题目内容
【题目】常见的电子气体有BCl3、N2O、SiH4及SiHCl3等。回答下列问题:
(1)气体B2H6与氯气混合可生成气态BCl3,每生成1.0 g BCl3放出5.9 kJ的热量,该反应的热化学方程式为______。
(2)25℃时反应 S(s) +H2(g)H2S(g) Kp1=6.0×105
Si(s)+2H2(g)SiH4(g) Kp2=7.8×106
则反应 Si(s)+2H2S(g)SiH4(g)+2S(s) Kp=_____(Kp为以分压表示的平衡常数,下同)。
(3)多晶硅制中发生一系列反应:
(I)4SiHCl3(g)Si(s)+3SiCl4(g)+2H2(g) △H1=a kJ /mol
(II)SiCl4(g)+H2(g)SiHCl3(g)+HCl(g) △H2=b kJ/mo1
(III)SiCl2(g)+H2(g)Si(s)+2HCl(g) △H3=c kJ/mo1
①反应SiHCl3 (g)SiCl2 (g) +HCl (g) △H=____kJ/mo1 (用含a、b、c的代数式表示)
②反应(I)(II)(III)的Kp与温度的关系如下图

属于吸热反应的是_________(填I、II或III);图中M点分压间满足关系:p(SiCl4)=______(用相关物质的分压p表示)。
(4)一种制取N2O的方法为 O2NNH2(aq)→N2O(g)+H2O(1),该反应的历程如下:
(I)O2NNH2(aq)![]() O2NNH-(aq) +H+(aq) (快速平衡)
O2NNH-(aq) +H+(aq) (快速平衡)
(II)O2NNH-(aq)![]() N2O(g) +OH-(aq) (慢)
N2O(g) +OH-(aq) (慢)
(III)H+(aq)+OH-(aq)![]() H2O(1) (快)
H2O(1) (快)
①活化能最大的反应步骤是_________(填I、II或III)。
②已知反应(I)的速率方程v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),(k1、k -1分别为正逆反应速率常数,反应(I)达到平衡时,平衡常数K=__________(用k1、k -1表示)。
③已知总反应速率方程为v=K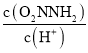 ,反应(II)的v(正)=k2c(O2NNH-),则K=________ (用k1、k -1、k2、k3表示)
,反应(II)的v(正)=k2c(O2NNH-),则K=________ (用k1、k -1、k2、k3表示)
【答案】B2H6(g)+6Cl2(g)=2BCl3(g)+6HCl(g) △H=-1386.5 kJmol-1 2.1710-5 a+3b-c I和II ![]() II
II ![]()
![]()
【解析】
(1)根据质量守恒定律,利用热化学方程式表示的意义,书写该反应的热化学方程式;
(2)将已知的热化学方程式叠加可得待求反应的热化学方程式,根据平衡常数的含义可得叠加反应的化学平衡常数;
(3)①根据盖斯定律将已知热化学方程式叠加,可得待求反应的热化学方程式;
②根据化学平衡常数与温度关系判断反应的热效应;M点是反应II、III的交点,两个反应的化学平衡常数相等,整理可得其数值;
(4)①反应的活化能越大,反应越难进行,反应速率越慢;
②根据反应达到平衡时,正、逆反应速率相等计算该反应的化学平衡常数;
③将反应(I)的速率方程v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),及总反应速率方程为v=K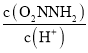 进行整理,可得K的表达式。
进行整理,可得K的表达式。
(1)B2H6与Cl2发生取代反应产生BCl3和HCl,每反应产生1.0 g BCl3放出5.9 kJ的热量,则反应产生2 mol BCl3放出热量Q=2 mol×111.5 g/mol×5.9 kJ/mol=1386.5 kJ,所以气体B2H6与氯气混合生成气态BCl3的热化学方程式为:B2H6(g)+6Cl2(g)=2BCl3(g)+6HCl(g) △H=-1386.5 kJmol-1;
(3)①S(s) +H2(g)H2S(g)Kp1=![]() =6.0×105,
=6.0×105,
②Si(s)+2H2(g)SiH4(g)Kp2=![]() =7.8×106,
=7.8×106,
根据盖斯定律,将②-①×2,整理可得反应Si(s)+2H2S(g)SiH4(g)+2S(s),K=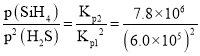 =2.1710-5;
=2.1710-5;
(3)①(I)4SiHCl3(g)Si(s)+3SiCl4(g)+2H2(g)△H1=a kJ /mol
(II)SiCl4(g)+H2(g)SiHCl3(g)+HCl(g)△H2=b kJ/mo1
(III)SiCl2(g)+H2(g)Si(s)+2HCl(g)△H3=c kJ/mo1
(I)+3×(II)- (III),整理可得:SiHCl3 (g)SiCl2 (g) +HCl (g) △H=(a+3b-c) kJ/mol;
②根据图象可知:温度升高,I、II的平衡常数增大,说明升高温度,反应I、II的化学平衡正向移动,而升高温度,反应III的化学平衡常数减小,说明升高温度反应III的化学平衡逆向移动。根据平衡移动原理:升高温度化学平衡向吸热反应方向移动,所以反应I、II的正反应为吸热反应,而反应III的正反应为放热反应;对于SiCl4(g)+H2(g)SiHCl3(g)+HCl(g)化学平衡常数Kp(II)=![]() ;对于反应III,化学平衡常数Kp(III)=
;对于反应III,化学平衡常数Kp(III)=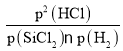 ,由于M点是两个反应交点,此时Kp(II)=Kp(III),所以
,由于M点是两个反应交点,此时Kp(II)=Kp(III),所以
![]()
(4)①由于反应的活化能越大,反应需消耗能量就越多,反应越难进行,化学反应速率就越慢。根据已知条件可知反应(II)化学反应速率最慢,所以活化能最大的反应步骤是II;
②对于反应(I)O2NNH2(aq)![]() O2NNH-(aq) +H+(aq),化学平衡常数K=
O2NNH-(aq) +H+(aq),化学平衡常数K=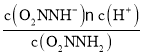 ,由于v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),当反应达到平衡时,v(正)=v(逆),所以k1c(O2NNH2)=k -1 c(O2NNH-)c(H+),则K=
,由于v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),当反应达到平衡时,v(正)=v(逆),所以k1c(O2NNH2)=k -1 c(O2NNH-)c(H+),则K=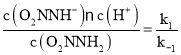 ;
;
③总反应速率方程为v=K ,由于反应(I)v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),反应(II)v(正)=k2c(O2NNH-),所以
,由于反应(I)v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),反应(II)v(正)=k2c(O2NNH-),所以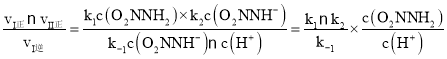 =K
=K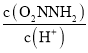 ,故K=
,故K=![]() 。
。