题目内容
铅蓄电池是最常见的二次电池,其构造示意图如下。发生反应的化学方程式为:
Pb(s) + PbO2(s) + 2H2SO4(aq) 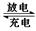 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)
下列说法不正确的是
| A.放电时,正极反应为:PbO2(s) + 4H+(aq) + SO42-(aq) +2e- = PbSO4(s) + 2H2O(l) |
| B.充电时,应将外接直流电源的正极与铅蓄电池的接线柱A相接 |
| C.实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接 |
| D.铅蓄电池做电源电解Na2SO4溶液时,当有2 mol O2产生时,消耗8 mol H2SO4 |
B
解析试题分析:A、放电时,是原电池,正极得电子发生还原反应,正确;B、 A是铅板,应与电源负极相连,错误;C、粗铜做阳极,B是PbO2,做正极,正确;D、2摩尔氧气转移8摩尔电子,电池中每转移2摩尔电子,消耗2摩尔硫酸,所以消耗硫酸8摩尔,正确。
考点:考查二次电池、粗铜精炼

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
相关题目
电解加工是利用电解原理使金属在电解液中溶蚀成预定形状的方法。电解加工一铜构件的示意图如下: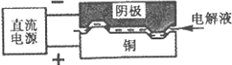
阳极铜件被溶蚀,而阴极的质量和形状都保持不变,则原始电解液不宜含有大量的
| A.SO42— | B.Cl— | C.Na+ | D.Cu2 + |
下图为某化工厂用石墨电解Na2CrO4溶液制备Na2Cr2O7的模拟装置,下列有关说法错误的是( )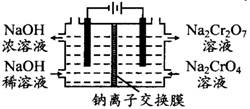
| A.溶液中OH-由阴极区流向阳极区 |
| B.阳极区产生的气体与阴极区产生的气体在相同状况 下体积之比为1:2 |
| C.阳极的电极反应式为:2H2O-4e-=O2↑+4H+ |
| D.Na2CrO4转化为Na2Cr2O7的离子方程式为:2CrO42-+2H+= Cr2O72-+H2O |
某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流计A指针偏转。下列有关描述正确的是
A.断开K2,闭合K1时,总反应的离子方程式为:2Cl-+2H+  H2↑+Cl2↑ H2↑+Cl2↑ |
| B.断开K2,闭合K1时,a是电源的正极,铁电极发生氧化反应 |
| C.断开K1,闭合K2时,石墨电极附近溶液变红,铁电极上的电极反应为:Cl2+2e→2Cl- |
| D.断开K1,闭合K2时,石墨电极作正极 |
对下列装置的叙述错误的是 
| A.X如果是HCl,则不论a和b用导线连接还是a和b分别连接直流电源正、负极时,H+的移动方向均相同 |
| B.X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 |
| C.X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应 |
| D.X如果是NaCl,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 |
用气体传感器可以检测汽车尾气中CO的含量。传感器是以燃料电池为工作原理,其装置如右图所示,该电池中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是
A.负极的电极反应式为:CO+O2- 2e-=CO2 2e-=CO2 |
| B.工作时电子由电极a通过传感器流向电极b |
| C.工作时电极b作正极,O2-由电极a流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
下图是某同学设计的原电池装置,下列叙述中正确的是
| A.电极Ⅰ上发生还原反应,作原电池的正极 |
| B.电极Ⅱ的电极反应式为:Cu2++2e-=" Cu" |
| C.该原电池的总反应为:2Fe3++Cu= Cu2++2Fe2+ |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
用a、b两个质量相等的Pt电极电解AlCl3和CuSO4的混合溶液[n(AlCl3):n(CuSO4)=1:9 ]。t1时刻a电极得到混合气体,其中Cl2在标准状况下为 224 mL(忽略气体的溶解);t2时刻Cu全部在电极上析出。下列判断正确的是
| A.a电极与电源的负极相连 |
| B.t2时,两电极的质量相差3.84 g |
| C.电解过程中,溶液的pH不断增大 |
| D.t2时,b电极的电极反应是2H2O-4e-=2OH-+H2↑ |
