题目内容
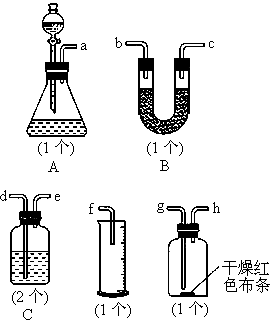
某同学用如图所示的装置来探究SO2的性质及有关实验.(1)实验前应先检验装置的气密性,方法是______
(2)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,写出化学方程式______.
(3)将制取的SO2气体通入C溶液中,请回答下列问题:
①若C溶液是紫色石蕊试液,通入少量SO2气体后,现象是______,继续通入过量的SO2气体,现象是______.
②若C溶液是橙色的溴水溶液,通入SO2气体后现象______,写出反应的离子方程式______.
③若C溶液是澄清石灰水,缓慢且持续通入SO2气体过程中,观察到的现象是______.
【答案】分析:(1)运用气体的体积热胀冷缩的原理检查装置的气密性;
(2)亚硫酸是弱酸,硫酸是强酸,利用强酸制弱酸的原理制取;
(3)①酸使紫色石蕊试液变红,二氧化硫不能漂白指示剂;
②二氧化硫与溴水发生氧化还原反应;
③二氧化硫通入到澄清石灰水中先生成亚硫酸钙沉淀,后沉淀溶解生成亚硫酸氢钙.
解答:解:(1)如果装置封闭,不漏气,用双手(或热毛巾)握住B时,相当于给装置中的气体加热,气体的体积热胀冷缩,C中有气泡产生,移开双手,温度降低,气体的体积缩小,C中导管形成一段水柱.故答案为:用双手(或热毛巾)握住B,C中有气泡产生,移开双手,C中导管形成一段水柱,说明不漏气;
(2)盐和酸反应生成新盐和新酸,该反应中生成的亚硫酸立即分解生成二氧化硫,故答案为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(3)①二氧化硫溶于水生成亚硫酸,亚硫酸使紫色溶液变为红色;二氧化硫虽有漂白性,但它不能使指示剂褪色.故答案为:紫色溶液变为红色 红色不褪去(或溶液颜色无变化);
②溴水与二氧化硫发生氧化还原反应,溴被二氧化硫中+4价的硫还原成-1价的溴,+4价的硫被溴氧化成+6价的硫,溴水褪色.故答案为:溴水褪色 SO2+Br2+2H2O═4H++SO42-+2Br-;
③二氧化硫通入到澄清石灰水中少量时反应为:SO2+Ca(OH)2=CaSO3↓+H2O,二氧化硫过量时:SO2+CaSO3+H2O=Ca(HSO3)2.故答案为:首先有白色沉淀生成,然后白色沉淀消失.
点评:该题主要考查了二氧化硫的制取以及二氧化硫漂白与被氧化的区别,解题时需从化合价角度分析漂白与被氧化的区别,才能正确解题.
(2)亚硫酸是弱酸,硫酸是强酸,利用强酸制弱酸的原理制取;
(3)①酸使紫色石蕊试液变红,二氧化硫不能漂白指示剂;
②二氧化硫与溴水发生氧化还原反应;
③二氧化硫通入到澄清石灰水中先生成亚硫酸钙沉淀,后沉淀溶解生成亚硫酸氢钙.
解答:解:(1)如果装置封闭,不漏气,用双手(或热毛巾)握住B时,相当于给装置中的气体加热,气体的体积热胀冷缩,C中有气泡产生,移开双手,温度降低,气体的体积缩小,C中导管形成一段水柱.故答案为:用双手(或热毛巾)握住B,C中有气泡产生,移开双手,C中导管形成一段水柱,说明不漏气;
(2)盐和酸反应生成新盐和新酸,该反应中生成的亚硫酸立即分解生成二氧化硫,故答案为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(3)①二氧化硫溶于水生成亚硫酸,亚硫酸使紫色溶液变为红色;二氧化硫虽有漂白性,但它不能使指示剂褪色.故答案为:紫色溶液变为红色 红色不褪去(或溶液颜色无变化);
②溴水与二氧化硫发生氧化还原反应,溴被二氧化硫中+4价的硫还原成-1价的溴,+4价的硫被溴氧化成+6价的硫,溴水褪色.故答案为:溴水褪色 SO2+Br2+2H2O═4H++SO42-+2Br-;
③二氧化硫通入到澄清石灰水中少量时反应为:SO2+Ca(OH)2=CaSO3↓+H2O,二氧化硫过量时:SO2+CaSO3+H2O=Ca(HSO3)2.故答案为:首先有白色沉淀生成,然后白色沉淀消失.
点评:该题主要考查了二氧化硫的制取以及二氧化硫漂白与被氧化的区别,解题时需从化合价角度分析漂白与被氧化的区别,才能正确解题.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
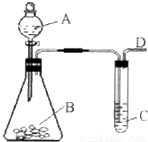
某同学用如图所示的装置来制取和探究气体(H2、O2、Cl2、SO2、NO2)的性质.
 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作
(2)如果用该装置制取H2、O2,可选用的试剂组合是 (填序号).
(3)五种气体中,可同时采用如图所示两种收集装置收集的气体是 .
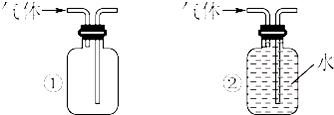
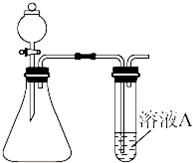
(4)两同学分别利用该装置制取并探究气体性质.同学甲利用亚硫酸钠固体与硫酸反应制取SO2,同学乙用高锰酸钾和盐酸制取氯气.请回答:
①写出亚硫酸钠固体与硫酸反应制取SO2的化学方程式: .
②若溶液A为溴水,通入SO2后现象是 ;若溶液A为溴化钠溶液,通入氯气时反应的离子方程式为 .实验证明Br2、SO2和Cl2氧化性由大到小的顺序为 .
③两同学想比较Cl2和SO2漂白速率的快慢,A溶液选取的是相同量的品红溶液.同时制取气体Cl2和SO2,观察品红溶液褪色的时间,比较褪色的快慢,该方法存在的缺陷为 .两同学还想比较Cl2和
SO2漂白的差异性,还需要的操作和可能观察到的现象为 .
 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作(2)如果用该装置制取H2、O2,可选用的试剂组合是
| H2 | O2 | |
| ① | Zn、稀盐酸 | KClO3、MnO2 |
| ② | Zn、稀硫酸 | H2O2溶液、MnO2 |
| ③ | Zn、稀硝酸 | KMnO4 |
(4)两同学分别利用该装置制取并探究气体性质.同学甲利用亚硫酸钠固体与硫酸反应制取SO2,同学乙用高锰酸钾和盐酸制取氯气.请回答:
①写出亚硫酸钠固体与硫酸反应制取SO2的化学方程式:
②若溶液A为溴水,通入SO2后现象是
③两同学想比较Cl2和SO2漂白速率的快慢,A溶液选取的是相同量的品红溶液.同时制取气体Cl2和SO2,观察品红溶液褪色的时间,比较褪色的快慢,该方法存在的缺陷为
SO2漂白的差异性,还需要的操作和可能观察到的现象为