题目内容
Fe、Cu都是人类最早使用的金属,某化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
(1)甲同学取两束细铜丝用砂纸打磨后在酒精灯上灼烧至红热,再分别迅速伸入盛满O2或Cl2的两个集气瓶中.其中能看到燃烧现象的集气瓶中所装气体是
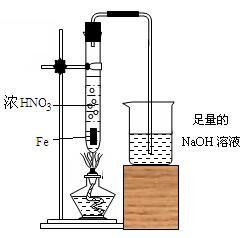
(2)乙同学为验证Fe在冷的浓HNO3中发生钝化,但能和热的浓HNO3反应,设计了如图所示的实验,请你指出其中的两处主要错误:①
(3)丙同学将乙同学的Fe和浓HNO3反应后的溶液冷却,再将溶液倒人烧杯中并加入一块Cu片,发现Cu片逐渐溶解.
①丙同学依据反应中某一现象得出了乙同学实验后HNO3过量的正确结论,他依据的反应现象是
②丙同学认为铜片溶解可能还有另一化学反应的存在原因,该反应的离子方程式是
(4)丁同学取0.05molOi与足量浓HNO3反应,采用了正确的试验方法,但收集产生的气体不足0.1mol,最有可能的原因是(用化学方程式表示)

(1)甲同学取两束细铜丝用砂纸打磨后在酒精灯上灼烧至红热,再分别迅速伸入盛满O2或Cl2的两个集气瓶中.其中能看到燃烧现象的集气瓶中所装气体是
Cl2
Cl2
.(2)乙同学为验证Fe在冷的浓HNO3中发生钝化,但能和热的浓HNO3反应,设计了如图所示的实验,请你指出其中的两处主要错误:①
两只试管中的液体均超过试管容积的
| 1 |
| 3 |
两只试管中的液体均超过试管容积的
;②| 1 |
| 3 |
加热液体的试管应与桌面成45°角向上倾斜
加热液体的试管应与桌面成45°角向上倾斜
纠正上述错误后,如将装置2中的铁片改成一段一端为螺旋状的铁丝,呈螺旋状的一端深人硝酸中,另一端伸出橡皮塞外,这种改进的优点是既能控制反应的进行又能减少氮氧化物的排放
既能控制反应的进行又能减少氮氧化物的排放
.(3)丙同学将乙同学的Fe和浓HNO3反应后的溶液冷却,再将溶液倒人烧杯中并加入一块Cu片,发现Cu片逐渐溶解.
①丙同学依据反应中某一现象得出了乙同学实验后HNO3过量的正确结论,他依据的反应现象是
试管上部出现红棕色气体
试管上部出现红棕色气体
.②丙同学认为铜片溶解可能还有另一化学反应的存在原因,该反应的离子方程式是
2Fe3++Cu=Cu2++2Fe2+
2Fe3++Cu=Cu2++2Fe2+
(4)丁同学取0.05molOi与足量浓HNO3反应,采用了正确的试验方法,但收集产生的气体不足0.1mol,最有可能的原因是(用化学方程式表示)
2NO2?N2O4
2NO2?N2O4
.
分析:(1)根据铜及氧气、氯气的性质分析;
(2)根据实验时,取用液体的体积及加热液体的注意事项分析;根据实验是否容易控制及反应产物量的多少分析;
(3)①根据二氧化氮的性质分析,二氧化氮能和水反应生成硝酸,当溶液中硝酸过量时,二氧化氮会剩余,气体呈红棕色;
②硝酸过量时,铁和硝酸反应生成三价铁,根据三价铁的性质分析;
(4)二氧化氮能发生可逆反应生成四氧化二氮,据此分析;
(2)根据实验时,取用液体的体积及加热液体的注意事项分析;根据实验是否容易控制及反应产物量的多少分析;
(3)①根据二氧化氮的性质分析,二氧化氮能和水反应生成硝酸,当溶液中硝酸过量时,二氧化氮会剩余,气体呈红棕色;
②硝酸过量时,铁和硝酸反应生成三价铁,根据三价铁的性质分析;
(4)二氧化氮能发生可逆反应生成四氧化二氮,据此分析;
解答:解:(1)铜在氧气中不燃烧,在氯气中能燃烧产生棕黄色烟,故选氯气.
(2)加热液体时,试管内的液体不能超过试管的三分之一,超过三分之一时,加热过程中容易产生暴沸,造成安全事故;加热液体的试管应与桌面成45°角向上倾斜,不能竖直向上;改进后的铜丝容易抽拉,即容易控制反应的进行,从而减少氮氧化物的排放;
故答案为:两只试管中的液体均超过试管容积的
;加热液体的试管应与桌面成45°角向上倾斜;既能控制反应的进行又能减少氮氧化物的排放.
(3)①二氧化氮能和水反应生成硝酸和一氧化氮,当溶液中硝酸过量时,抑制二氧化氮的溶解,所以可看到气体呈红棕色;
故答案为:试管上部出现红棕色气体.
②硝酸过量时,铁和硝酸反应生成三价铁,三价铁和铜能反应生成二价铁离子和铜离子,从而使铜片溶解,发生反应为
2Fe3++Cu=Cu2++2Fe2+.
故答案为:2Fe3++Cu=Cu2++2Fe2+.
(4)二氧化氮能发生可逆反应生成四氧化二氮,2NO2?N2O4,从而使收集的气体小于0.1mol.
故答案为:2NO2?N2O4
(2)加热液体时,试管内的液体不能超过试管的三分之一,超过三分之一时,加热过程中容易产生暴沸,造成安全事故;加热液体的试管应与桌面成45°角向上倾斜,不能竖直向上;改进后的铜丝容易抽拉,即容易控制反应的进行,从而减少氮氧化物的排放;
故答案为:两只试管中的液体均超过试管容积的
| 1 |
| 3 |
(3)①二氧化氮能和水反应生成硝酸和一氧化氮,当溶液中硝酸过量时,抑制二氧化氮的溶解,所以可看到气体呈红棕色;
故答案为:试管上部出现红棕色气体.
②硝酸过量时,铁和硝酸反应生成三价铁,三价铁和铜能反应生成二价铁离子和铜离子,从而使铜片溶解,发生反应为
2Fe3++Cu=Cu2++2Fe2+.
故答案为:2Fe3++Cu=Cu2++2Fe2+.
(4)二氧化氮能发生可逆反应生成四氧化二氮,2NO2?N2O4,从而使收集的气体小于0.1mol.
故答案为:2NO2?N2O4
点评:本题考查了常见金属铜和铁的化学性质,难度不大,写三价铁离子和铜反应的离子方程式时要注意电荷守恒.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目