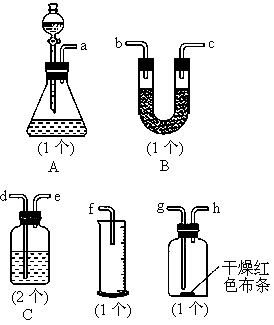
题目内容
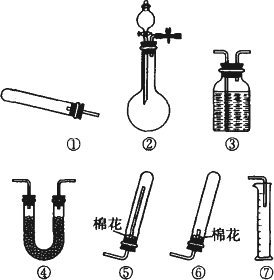
某同学用如图所示的装置来制取和探究气体(H2、O2、Cl2、SO2、NO2)的性质.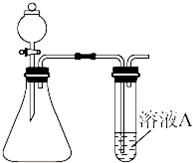 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作(2)如果用该装置制取H2、O2,可选用的试剂组合是
| H2 | O2 | |
| ① | Zn、稀盐酸 | KClO3、MnO2 |
| ② | Zn、稀硫酸 | H2O2溶液、MnO2 |
| ③ | Zn、稀硝酸 | KMnO4 |
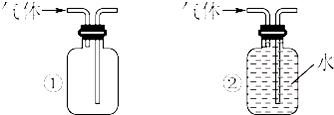
(4)两同学分别利用该装置制取并探究气体性质.同学甲利用亚硫酸钠固体与硫酸反应制取SO2,同学乙用高锰酸钾和盐酸制取氯气.请回答:
①写出亚硫酸钠固体与硫酸反应制取SO2的化学方程式:
②若溶液A为溴水,通入SO2后现象是
③两同学想比较Cl2和SO2漂白速率的快慢,A溶液选取的是相同量的品红溶液.同时制取气体Cl2和SO2,观察品红溶液褪色的时间,比较褪色的快慢,该方法存在的缺陷为
SO2漂白的差异性,还需要的操作和可能观察到的现象为
分析:(1)仪器按要求组装好后应先进行气密性检验,后加药品;
(2)①中KClO3、MnO2制O2需要加热,不能用图示装置;③中Zn和稀硝酸反应不能生成 H2;
(3)用图①所示方法收集的气体是H2,用图②所示方法收集的气体是H2、O2,故同时可用①②两方法收集的为H2;
(4)①亚硫酸钠和硫酸反应生成硫酸钠、二氧化硫和水;
②SO2通入溴水,溴水褪色,离子反应方程式为Br2+SO2+2H2O═4H++2Br-+SO42-;Cl2通入NaBr溶液中,离子方程式为2Br-+Cl2═Br2+2Cl-,由反应关系可知,Br2、SO2、Cl2的氧化性强弱关系为Cl2>Br2>SO2;
③比较Cl2和SO2的漂白速率,应在外界条件完全一致的情况下进行,否则没有可比性,Cl2和SO2的漂白性差异在于生成无色产物的稳定性大小.
(2)①中KClO3、MnO2制O2需要加热,不能用图示装置;③中Zn和稀硝酸反应不能生成 H2;
(3)用图①所示方法收集的气体是H2,用图②所示方法收集的气体是H2、O2,故同时可用①②两方法收集的为H2;
(4)①亚硫酸钠和硫酸反应生成硫酸钠、二氧化硫和水;
②SO2通入溴水,溴水褪色,离子反应方程式为Br2+SO2+2H2O═4H++2Br-+SO42-;Cl2通入NaBr溶液中,离子方程式为2Br-+Cl2═Br2+2Cl-,由反应关系可知,Br2、SO2、Cl2的氧化性强弱关系为Cl2>Br2>SO2;
③比较Cl2和SO2的漂白速率,应在外界条件完全一致的情况下进行,否则没有可比性,Cl2和SO2的漂白性差异在于生成无色产物的稳定性大小.
解答:解:(1)仪器按要求组装好后应先进行气密性检验,后加药品,装药品前,应先进行的操作是检验装置气密性;
故答案为:检查装置气密性;
(2)①中KClO3、MnO2制O2需要加热,不能用图示装置;③中Zn和稀硝酸反应不能生成 H2;②Zn和稀硫酸不需要加热反应生成氢气,H2O2溶液和MnO2 固体不需要加热反应生成氧气,用该装置制取H2、O2,可选用的试剂组合是②;
故答案为:②;
(3)用图①所示方法收集的气体是H2,用图②所示方法收集的气体是H2、O2,Cl2、SO2、NO2比空气重不能用①装置收集,SO2、NO2和水反应,不能用这种②收集,故同时可用①②两方法收集的为H2;
故答案为:H2;
(4)①亚硫酸钠和硫酸反应生成硫酸钠、二氧化硫和水,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
②若溶液A为溴水,通入SO2后现象是,溴水褪色,离子反应方程式为Br2+SO2+2H2O═4H++2Br-+SO42-;Cl2通入NaBr溶液中,离子方程式为2Br-+Cl2═Br2+2Cl-,由反应关系和氧化还原反应中 氧化剂氧化性大于氧化产物分析判断可知,Br2、SO2、Cl2的氧化性强弱关系为Cl2>Br2>SO2;
故答案为:溴水褪色;2Br-+Cl2═Br2+2Cl-,Cl2>Br2>SO2;
③比较Cl2和SO2的漂白速率,应在外界条件完全一致的情况下进行,否则没有可比性,Cl2和SO2的漂白性差异在于生成无色产物的稳定性大小,二氧化硫漂白的溶液加热恢复原来红色;
故答案为:外界条件不同,无可比性;二氧化硫的漂白的溶液加热恢复原来的颜色红色.
故答案为:检查装置气密性;
(2)①中KClO3、MnO2制O2需要加热,不能用图示装置;③中Zn和稀硝酸反应不能生成 H2;②Zn和稀硫酸不需要加热反应生成氢气,H2O2溶液和MnO2 固体不需要加热反应生成氧气,用该装置制取H2、O2,可选用的试剂组合是②;
故答案为:②;
(3)用图①所示方法收集的气体是H2,用图②所示方法收集的气体是H2、O2,Cl2、SO2、NO2比空气重不能用①装置收集,SO2、NO2和水反应,不能用这种②收集,故同时可用①②两方法收集的为H2;
故答案为:H2;
(4)①亚硫酸钠和硫酸反应生成硫酸钠、二氧化硫和水,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
②若溶液A为溴水,通入SO2后现象是,溴水褪色,离子反应方程式为Br2+SO2+2H2O═4H++2Br-+SO42-;Cl2通入NaBr溶液中,离子方程式为2Br-+Cl2═Br2+2Cl-,由反应关系和氧化还原反应中 氧化剂氧化性大于氧化产物分析判断可知,Br2、SO2、Cl2的氧化性强弱关系为Cl2>Br2>SO2;
故答案为:溴水褪色;2Br-+Cl2═Br2+2Cl-,Cl2>Br2>SO2;
③比较Cl2和SO2的漂白速率,应在外界条件完全一致的情况下进行,否则没有可比性,Cl2和SO2的漂白性差异在于生成无色产物的稳定性大小,二氧化硫漂白的溶液加热恢复原来红色;
故答案为:外界条件不同,无可比性;二氧化硫的漂白的溶液加热恢复原来的颜色红色.
点评:本题考查了气体制备方法和收集方法的装置选择,试剂选择,主要是我在性质的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目