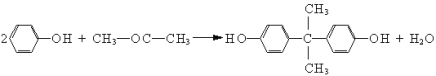
��Ŀ����
����Ŀ����ʽ�Ȼ�ͭ[Cux(OH)yClz��mH2O]����Ҫ��ũҩ��ҽҩ�м��壬��������ľ�ķ��������������Ӽ��ȡ��о�С����ʵ������ij����ͭ��(��Ҫ�ɷ�Cu��CuO��������Fe3O4��Ni��A12O3)�Ʊ���ʽ�Ȼ�ͭ���������£�
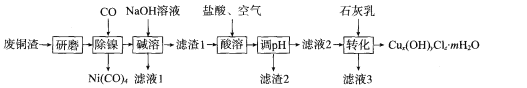
�ش��������⣺
(l)����ĥ����Ŀ��Ϊ___ ��
(2)����������Ŀ��Ϊ __ ��
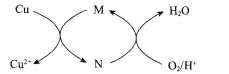
(3)��������ʱ����Fe3+��Ӧ�����ӷ���ʽΪ ___�����ɵ�Fe3+��Cu������������Ӧ�Ĵ�ԭ����ͼ��ʾ��N�Ļ�ѧʽΪ____��
(4)��������ʱ�¶Ȳ��ܹ��ߵ�����Ϊ____��
(5)����Һ2��c(Fe3+)=4��10-8 mol/L��pH=4����Ksp[Fe(OH)3]=____��
(6)Ϊ�ⶨCux (OH)yClz��mH2O����ɣ��������²�����ȡ��Ʒ2.232 g�����������ܽ�����100 mL��Һ��ȡ25. 00 mL��Һ��������AgNO3��Һ������0.3444 g��������ȡ25. 00 mL��Һ����0.1600 mol��L-1��EDTA��Һ�ζ�Cu2+(Cu2+��EDTA�����ʵ���֮��1��1��Ӧ)���ζ����յ�ʱ���ı�Һ���Ϊ30. 00 mL��
���ܽ���Ʒ������Ļ�ѧʽΪ ___��
�ڸ���Ʒ�Ļ�ѧʽΪ____��
���𰸡��ӿ컯ѧ��Ӧ���ʣ�ʹ��Ӧ��� ��Al2O3ת��ΪNaAlO2�������ȥ 4Fe3O4 + O2 + 36H+ = 12Fe3+ + 18H2O Fe2+(��FeCl2) �¶����ߣ�����ӷ��������ܽ�ȼ�С���ᵼ�·�Ӧ���ʽ��ͣ�������������� 4��10-38 HNO3 Cu2(OH)3Cl��H2O
��������
��1������Ӧ����ĽӴ�����ɼӿ컯ѧ��Ӧ���ʣ�
��2��Al2O3��������������ת��Ϊƫ�����ƣ�
��3���������������������Fe3O4��Fe3+��ʽ���ڣ�����������ԭ��Ӧ������ƽ�����ӷ���ʽ�������ݷ�Ӧԭ������Fe3+�Ը÷�Ӧ�д����ã����ͼ��֪��CuԪ�صĻ��ϼ����ߣ���M��FeԪ�صĻ��ϼ۽��ͣ�
��4�����������ӷ������Իش�
��5���ܶȻ��ļ��㹫ʽKsp[Fe(OH)3] = c(Fe3+)��c3(OH-)����
��6��ϡ�����ữ��������������Һ�е������ӷ�Ӧ���ɰ�ɫ����������AgCl���������ʵ�������������ӵ����ʵ������ٸ���EDTA�����ʵ�������ó�ͭ���ӵ����ʵ�����������������ͭ����֮�䰴���ʵ���Ϊ1:2��Ӧ������Ӽ���ˮ�����ʵ������������ʵ���֮�ȵ���ԭ�Ӹ����ȼ�����û�ѧʽ��ɡ�
��1������ĥ�����壬������Ӧ��ĽӴ�������Ӷ��ӿ컯ѧ��Ӧ���ʣ�ʹ��Ӧ����֣�
�ʴ�Ϊ���ӿ컯ѧ��Ӧ���ʣ�ʹ��Ӧ��֣�
��2��������ֻ��Al2O3Ϊ����������ɱ�����������ת��ΪNaAlO2����ڷ����ȥ��������������Ŀ��Ϊ����Al2O3ת��ΪNaAlO2�������ȥ��
��Al2O3ת��ΪNaAlO2�������ȥ��
��3����������ʱ������Fe3O4������������������������Һ����Fe3+��ʽ���ڣ����ܵ����ӷ���ʽΪ��4Fe3O4 + O2 + 36H+ = 12Fe3+ + 18H2O���ɿ���Fe3O4�ܽ��������У�����FeCl2��FeCl3�����ɵ�FeCl2�ٱ������е�����������������Ԫ����Fe3+��ʽ���ڣ����ͼʾ��Ϣ��Fe3+�Ը÷�Ӧ�д����ã����ͼ��֪��CuԪ�صĻ��ϼ����ߣ���M��FeԪ�صĻ��ϼ۽��ͣ����֪MΪFe3+(��FeCl3)��NΪFe2+(��FeCl2)��
�ʴ�Ϊ��4Fe3O4 + O2 + 36H+ = 12Fe3+ + 18H2O ��Fe2+(��FeCl2)
��4�����������������������ӷ������¶ȹ��ߣ�����ӷ����������������ܽ�ȼ�С����ֱ�ӵ��·�Ӧ���ʽ��ͣ�������������֣�
�ʴ�Ϊ���¶ȹ��ߣ�����ӷ��������ܽ�ȼ�С���ᵼ�·�Ӧ���ʽ��ͣ��������������
��5�������£���Һ��pH = 4������Һ�е�c(OH-) = ![]() = 10-10 mol/L,����Fe3+ʱ�����ܶȻ�Ksp[Fe(OH)3] = c(Fe3+)��c3(OH-) = 4��10-8 mol/L��(10-10 mol/L)3 = 4��10-38��
= 10-10 mol/L,����Fe3+ʱ�����ܶȻ�Ksp[Fe(OH)3] = c(Fe3+)��c3(OH-) = 4��10-8 mol/L��(10-10 mol/L)3 = 4��10-38��
�ʴ�Ϊ��4��10-38��
��6���������֪����������������õ��ij���ΪAgCl��Ϊ��Ӱ����������ɣ��Ҳ��������ʣ�������������ӦΪHNO3������AgCl
�ʴ�Ϊ��HNO3��
n(Cl) = n(AgCl) �� ![]() =
= ![]() ��
��![]() = 9.6000��103 mol��
= 9.6000��103 mol��
n(Cu2+) = n(EDTA)��![]() = 0.1600 molL1��30.00 ��103 L��
= 0.1600 molL1��30.00 ��103 L��![]() = 1.9200��102 mol��
= 1.9200��102 mol��
n(OH)=2n(Cu2+)n(Cl) = 2��1.9200��102 mol 9.6000��103 mol = 2.8800��102 mol��
m(Cl) = 9.600��10
m(Cu2+) = 1.9200��102 mol��64 gmol1 = 1.2288 g��
m(OH) =2.8800��102 mol��17 gmol1 = 0.4896 g��
n(H2O) = ![]() = 9.600��103 mol��
= 9.600��103 mol��
��a:b:c:x = n(Cu2+):n(OH):n(Cl):n(H2O) = 2:3:1:1��
����ѧʽΪCu2(OH)3ClH2O��
�ʴ�Ϊ��Cu2(OH)3Cl��H2O��

 ʱ�����������ҵԭ���ܳ�����ϵ�д�
ʱ�����������ҵԭ���ܳ�����ϵ�д�����Ŀ�����в���������ͽ��۾���ȷ����
ѡ�� | ���� | ���� | ���� |
A | ���������Ũ�ȵ�HX��HY��������п��Ӧ���ռ���������������¼����� | HX�ռ����������� | HX��ǿ�� |
B | ����з�̪��̼������Һ�м����������Ȼ������� | ��ɫ��dz | ̼������Һ�д���ˮ��ƽ�� |
C | ��ӦFeCl3+3KSCN | ��ɫ��dz | ����KCl��Ũ�ȣ�ƽ�������ƶ� |
D | �����·ֱ������Ũ�ȵ�K2SO3��KCl��Һ��pH | pH:K2SO3>KCl | �ǽ����ԣ�Cl>S |
A. AB. BC. CD. D