题目内容
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH CH3COO— + H+ K1=1.75×10-5 △H1>0
CH3COO— + H+ K1=1.75×10-5 △H1>0
CH3COO— + H2O CH3COOH + OH— K2=5.71×10-10 △H2>0
CH3COOH + OH— K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是
CH3COOH
 CH3COO— + H+ K1=1.75×10-5 △H1>0
CH3COO— + H+ K1=1.75×10-5 △H1>0CH3COO— + H2O
 CH3COOH + OH— K2=5.71×10-10 △H2>0
CH3COOH + OH— K2=5.71×10-10 △H2>0常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是
| A.对混合溶液进行微热,K1增大、K2减小 |
| B.混合溶液的pH<7 |
| C.混合溶液中c(CH3COO—)>c(Na+) |
| D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO—)减小 |
BC
试题分析:A、电离和水解均是吸热的,所以对混合溶液进行微热,K1、K2均增大,A不正确;B、由于醋酸根的水解常数小于醋酸的电离常数,因此二者浓度相同的混合液显酸性,即pH<7,B正确;C、醋酸的电离程度大于醋酸根的水解程度,溶液显酸性,则根据电荷守恒混合溶液中c(CH3COO—)+c(OH—)=c(Na+)+c(H+)可知,混合溶液中c(CH3COO—)>c(Na+),C正确;D、温度不变,若在混合溶液中加入少量NaOH固体,中和氢离子,促进醋酸的电离,所以溶液中c(CH3COO—)增大,D不正确,答案选BC。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
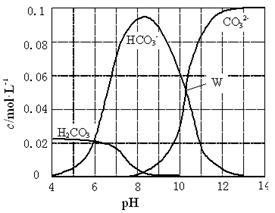
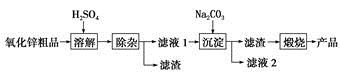
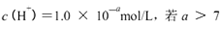 时,则该溶液的pH一定为14-a
时,则该溶液的pH一定为14-a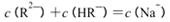
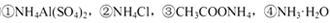 溶液中,c (NH4+)由大到小的顺序是:①>②>③>④
溶液中,c (NH4+)由大到小的顺序是:①>②>③>④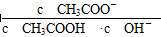 不变
不变