题目内容
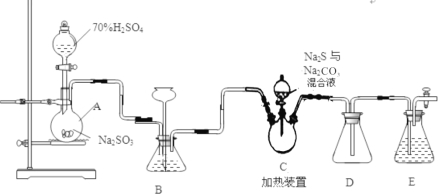
【题目】二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸 (H2C2O4)在60℃时反应制得,某学生拟用下图所示的装置模拟制取并收集ClO2。
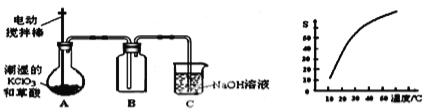
(1)B必须放在冰水浴中控制温度,其原因是_______________。
(2)反应后在装置C中可得NaClO2溶液.已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO23H2O,在温度高于38℃时析出晶体是NaClO2 。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a______;b_______;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
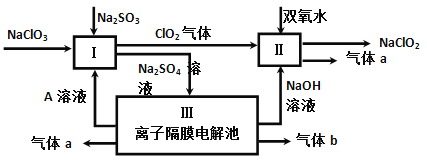
①I、III中发生反应的还原剂分别是_____、_____(填化学式)。
②Ⅱ中反应的离子方程式是___________。
③ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式______。
④NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量_______。(填“相同”,“不同”或“无法判断”)
【答案】
(1)使ClO2充分冷凝,减少挥发;
(2)a.蒸发结晶;b.趁热过滤;
(3)①Na2SO3;H2O;
②2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
③5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O;
④相同。
【解析】
试题分析:(1)二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,B必须放在冰水浴中控制温度,其原因是使ClO2充分冷凝,减少挥发;
(2)根据题给信息:NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。从NaClO2溶液中制得NaClO2的操作步骤:a.蒸发结晶;
B.趁热过滤;③洗涤;④干燥;
(3)①根据题给流程知反应I为2ClO3―+SO32―+2H+ =2ClO2+SO42―+H2O,其中SO32― 中S由+4价变成+6价,Na2SO3作还原剂;反应Ⅲ为2H2O![]() 2H2↑+O2↑,还原剂为H2O;②根据题给流程知ClO2和H2O2在碱性条件反应生成NaClO2,ClO2中氯元素的化合价由+4价降低为+3价,H2O2中氧由―1价升高到0价,离子方程式为2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O;③亚氯酸钠和稀盐酸发生歧化反应,生成氯化钠、二氧化氯和水,化学方程式为5NaClO2 + 4HCl = 5NaCl + 4ClO2↑+ 2H2O;④ClO2―、ClO3―与Fe2+ 反应最终都变成Cl― ,变质前后转移的电子数相同,反以消耗Fe2+的物质的量相同。
2H2↑+O2↑,还原剂为H2O;②根据题给流程知ClO2和H2O2在碱性条件反应生成NaClO2,ClO2中氯元素的化合价由+4价降低为+3价,H2O2中氧由―1价升高到0价,离子方程式为2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O;③亚氯酸钠和稀盐酸发生歧化反应,生成氯化钠、二氧化氯和水,化学方程式为5NaClO2 + 4HCl = 5NaCl + 4ClO2↑+ 2H2O;④ClO2―、ClO3―与Fe2+ 反应最终都变成Cl― ,变质前后转移的电子数相同,反以消耗Fe2+的物质的量相同。