题目内容
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置):
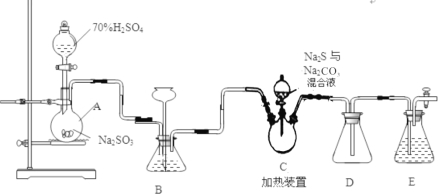
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)(I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)(II)
S(s)+Na2SO3(aq)![]() Na2S2O3(aq)(III)
Na2S2O3(aq)(III)
实验步骤:
①待Na2S和Na2CO3完全消耗后,结束反应。
②向C中烧瓶加入Na2S和Na2CO3混合溶液
③检查装置气密性,按图示加入试剂。
④向A中烧瓶滴加浓H2SO4。
⑤过滤C中混合物,滤液经蒸发、结晶、过滤、洗涤、干燥,得到产品。
(1)E中的试剂是____________(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)正确的操作顺序是
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,________________ ,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是___________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过____________方法提纯。
【答案】
Ⅱ.(1)B;(2)③②④①⑤;(3)C
Ⅲ.(1)过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl(2)先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液;(3)重结晶;
【解析】
试题分析:Ⅱ.(1)E中的试剂是NaOH溶液,目的是吸收剩余的二氧化硫,因为二氧化硫能与氢氧化钠溶液反应,与稀H2SO4和饱和NaHSO3溶液不反应,故答案为:B;
(2)反应中有气体参与,首先检查装置气密性,按图示加入试剂,然后向C中烧瓶加入Na2S和Na2CO3混合溶液,向A中烧瓶滴加浓H2SO4,待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经蒸发、结晶、过滤、洗涤、干燥,得到产品。因此正确的操作顺序为③②④①⑤,故答案为:③②④①⑤;
(3)a.二氧化硫能够溶于水,二氧化硫通过蒸馏水,不能很好的观察SO2的生成速率,错误;b.二氧化硫能够与饱和Na2SO3溶液反应生成亚硫酸氢钠,不能很好的观察SO2的生成速率,错误;c.二氧化硫与饱和NaHSO3溶液不反应,能够观察SO2的生成速率,正确;d.二氧化硫能够与饱和NaHCO3溶液反应放出二氧化碳气体,不能很好的观察SO2的生成速率,错误;故选c;
Ⅲ.(1)根据:Na2S2O35H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4,故答案为:过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸;
(2)因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液,故答案为:先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液;
(3)Na2S2O35H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯,故答案为:重结晶

 出彩同步大试卷系列答案
出彩同步大试卷系列答案