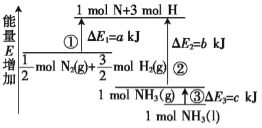
题目内容
【题目】人们认识最早的盐是食盐,![]() 尚书
尚书![]() 说命
说命![]() 记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对
记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对![]() 、
、![]() 、
、![]() 、
、![]() 四种常见的盐进行探究。回答下列问题:
四种常见的盐进行探究。回答下列问题:
⑴已知![]() 时,AgCl的溶度积为
时,AgCl的溶度积为![]() ,则AgCl在
,则AgCl在![]() 溶液中的
溶液中的![]() 为________
为________![]() 。
。
⑵![]() 时,
时,![]() 溶液的
溶液的![]() ,则关于该溶液中
,则关于该溶液中![]() 的说法正确的是________。
的说法正确的是________。
A.与m无关的定值 ![]() 与m有关的定值
与m有关的定值 ![]() 与
与![]() 有关的不定值
有关的不定值
⑶![]() 时,将
时,将![]() 溶液和
溶液和![]() 溶液各
溶液各![]() 混合,此时混合溶液的
混合,此时混合溶液的![]() ,则
,则![]() 的电离平衡常数
的电离平衡常数![]() ________
________![]() 用含n的表达式表示
用含n的表达式表示![]() 。
。
⑷将![]() 、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜
、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜![]() ,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为
,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为![]() ,另一份高温灼烧后只得到
,另一份高温灼烧后只得到![]() 固体。所得数据显示
固体。所得数据显示![]() ,则该碱式硫酸铜的化学式中
,则该碱式硫酸铜的化学式中![]() ________。
________。
⑸![]() 时,向
时,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的盐酸
的盐酸![]() ,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量
,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量![]() 纵轴
纵轴![]() 也发生变化,如图所示:
也发生变化,如图所示:
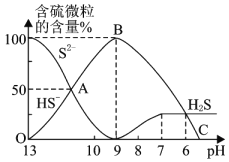
![]() 反应到A点时,溶液中的离子浓度大小的关系为________。
反应到A点时,溶液中的离子浓度大小的关系为________。
![]() 点对应的溶液中大量存在的溶质是________。
点对应的溶液中大量存在的溶质是________。
![]() 混合溶液的
混合溶液的![]() ________时,溶液中开始有
________时,溶液中开始有![]() 气体放出。
气体放出。
【答案】![]()
![]()
![]() 或者
或者![]()
![]()
![]()
![]() 和NaCl 7
和NaCl 7
【解析】
⑴根据AgCl的溶度积和氯离子浓度计算银离子浓度。
⑵根据电荷守恒、物料守恒得出关系,再计算氢氧根浓度。
⑶根据混合后得到的物质以及平衡常数表达式进行计算。
⑷根据关系式和比例关系进行计算。
![]() 当反应到A点时,得到硫化钠和硫氢化钠的混合溶液,由图可知,溶液中
当反应到A点时,得到硫化钠和硫氢化钠的混合溶液,由图可知,溶液中![]() 且溶液呈碱性,则
且溶液呈碱性,则![]() ,得到溶液中的离子浓度大小。
,得到溶液中的离子浓度大小。
![]() 根据图示可知,B点时
根据图示可知,B点时![]() ,溶液中只含有硫氢化钠,不含硫化钠,即B点表示的是硫化钠恰好转化为硫氢化钠,方程式为
,溶液中只含有硫氢化钠,不含硫化钠,即B点表示的是硫化钠恰好转化为硫氢化钠,方程式为![]() 。
。
![]() 由图像可知,当
由图像可知,当![]() 时,溶液中
时,溶液中![]() 不再增多,说明
不再增多,说明![]() 在水中的溶解已达到饱和。
在水中的溶解已达到饱和。
⑴![]() 溶液中
溶液中![]() ,根据AgCl的溶度积为
,根据AgCl的溶度积为![]() ,则
,则![]() ,故答案为:
,故答案为:![]() 。
。
![]() 溶液中存在电荷守恒:
溶液中存在电荷守恒:![]() ,
,
物料守恒:![]() ,根据两个等式可得出
,根据两个等式可得出![]() ,因为
,因为![]() 时,
时,![]()
![]() 溶液的
溶液的![]() ,则
,则![]() ,故答案为:B;
,故答案为:B;
![]() 混合反应后得
混合反应后得![]()
![]() 溶液,达到电离平衡时,
溶液,达到电离平衡时,![]() ,
,![]() ,则
,则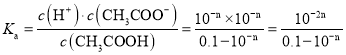 ,或
,或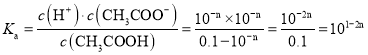 ,故答案为:
,故答案为:![]() 或
或![]() 。
。
![]() 一份滴加稀硫酸至恰好完全溶解,反应为
一份滴加稀硫酸至恰好完全溶解,反应为![]() ,另一份高温灼烧后只得到
,另一份高温灼烧后只得到![]() 固体,根据
固体,根据![]() ,
,![]() ,可得
,可得 ,则该碱式硫酸铜的化学式中
,则该碱式硫酸铜的化学式中![]() ,故答案为:
,故答案为:![]() 。
。
![]() 当反应到A点时,得到硫化钠和硫氢化钠的混合溶液,由图可知,溶液中
当反应到A点时,得到硫化钠和硫氢化钠的混合溶液,由图可知,溶液中![]() 且溶液呈碱性,则
且溶液呈碱性,则![]() ,则溶液中的离子浓度大小关系为
,则溶液中的离子浓度大小关系为![]() ,故答案为:
,故答案为:![]() 。
。
![]() 根据图示可知,B点时
根据图示可知,B点时![]() ,溶液中只含有硫氢化钠,不含硫化钠,即B点表示的是硫化钠恰好转化为硫氢化钠,方程式为
,溶液中只含有硫氢化钠,不含硫化钠,即B点表示的是硫化钠恰好转化为硫氢化钠,方程式为![]() ,所以B点对应的溶液中大量存在的溶质是NaHS和NaCl,故答案为:NaHS和NaCl。
,所以B点对应的溶液中大量存在的溶质是NaHS和NaCl,故答案为:NaHS和NaCl。
![]() 由图像可知,当
由图像可知,当![]() 时,溶液中
时,溶液中![]() 不再增多,说明
不再增多,说明![]() 在水中的溶解已达到饱和,即混合溶液的
在水中的溶解已达到饱和,即混合溶液的![]() 时,溶液中开始有
时,溶液中开始有![]() 气体放出,故答案为:7。
气体放出,故答案为:7。

【题目】高锰酸钾是一种典型的强氧化剂,热分解产生锰酸钾、二氧化锰、氧气。完成下列填空:
I.已知:①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol,②S(s)+O2(g)=SO2(g)ΔH=-298kJ/mol,③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1068kJ/mol。
(1)固体MnO2和二氧化硫气体反应生成MnSO4固体的热化学方程式为_____。
Ⅱ.草酸钠滴定法测定高锰酸钾的质量分数涉及到的反应:C2O42-+2H+→H2C2O4(草酸),5H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O
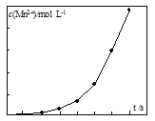
(2)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,Mn2+浓度变化由缓慢增大后迅速增大的原因是_______。
Ⅲ.KMnO4是一种常用消毒剂。
(3)KMnO4消毒机理与下列物质相似的是____(填序号)。
A.消毒酒精(75%) B. 双氧水 C. 84消毒液 D. 肥皂水 E.活性炭 F.SO2
(4)测定KMnO4产品的纯度可用标准Na2S2O3溶液滴定。
①配制500ml0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、量筒、玻璃棒和___。
②取KMnO4粗产品0.7000g溶于水,并加入稀硫酸进行酸化,将所得溶液用0.1000mol/L标准Na2S2O3溶液进行滴定,滴定至终点记录实验消耗Na2S2O3溶液的体积。重复步骤②、③,三次平行实验数据如表:
实验次数 | 1 | 2 | 3 |
消耗Na2SO3溶液体积/ml | 19.30 | 20.98 | 21.02 |
(已知:S2O32-被MnO4-氧化为SO42- )
计算该KMnO4产品的纯度为___。(保留三位有效数字)