题目内容
【题目】高锰酸钾是一种典型的强氧化剂,热分解产生锰酸钾、二氧化锰、氧气。完成下列填空:
I.已知:①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol,②S(s)+O2(g)=SO2(g)ΔH=-298kJ/mol,③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1068kJ/mol。
(1)固体MnO2和二氧化硫气体反应生成MnSO4固体的热化学方程式为_____。
Ⅱ.草酸钠滴定法测定高锰酸钾的质量分数涉及到的反应:C2O42-+2H+→H2C2O4(草酸),5H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O
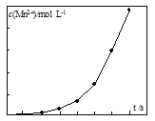
(2)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,Mn2+浓度变化由缓慢增大后迅速增大的原因是_______。
Ⅲ.KMnO4是一种常用消毒剂。
(3)KMnO4消毒机理与下列物质相似的是____(填序号)。
A.消毒酒精(75%) B. 双氧水 C. 84消毒液 D. 肥皂水 E.活性炭 F.SO2
(4)测定KMnO4产品的纯度可用标准Na2S2O3溶液滴定。
①配制500ml0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、量筒、玻璃棒和___。
②取KMnO4粗产品0.7000g溶于水,并加入稀硫酸进行酸化,将所得溶液用0.1000mol/L标准Na2S2O3溶液进行滴定,滴定至终点记录实验消耗Na2S2O3溶液的体积。重复步骤②、③,三次平行实验数据如表:
实验次数 | 1 | 2 | 3 |
消耗Na2SO3溶液体积/ml | 19.30 | 20.98 | 21.02 |
(已知:S2O32-被MnO4-氧化为SO42- )
计算该KMnO4产品的纯度为___。(保留三位有效数字)
【答案】MnO2(s)+SO2(g)=MnSO4(s) H=-250KJ· mol -1 随着c(Mn2+)的不断增大,反应速率大大加快,生成的Mn2+可能对该反应有催化作用,且c(Mn2+)越大,催化效果越好 BC 500mL容量瓶、胶头滴管 75.8%
【解析】
I. ①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol ①
②S(s)+O2(g)=SO2(g) ΔH=-298kJ/mol ②
③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1068kJ/mol ③
(1)将①+③-②得,固体MnO2和二氧化硫气体反应生成MnSO4固体的热化学方程式为MnO2(s)+SO2(g)=MnSO4(s) H=-250KJ· mol -1。
Ⅱ.(2)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,Mn2+浓度变化由缓慢增大后迅速增大的原因是随着c(Mn2+)的不断增大,反应速率大大加快,生成的Mn2+可能对该反应有催化作用,且c(Mn2+)越大,催化效果越好
Ⅲ.(3)KMnO4是强氧化剂,与其相似的是双氧水和84消毒液。
(4)①配制500ml0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、量筒、玻璃棒和500mL容量瓶、胶头滴管。
②从数据的比较中可以看出,第1组数据为失真数据。后两组数据的平均值为21mL。
滴定过程中发生反应的离子方程式为8MnO4- + 5S2O32- + 14H+ = 10SO42- + 8Mn2+ + 7H2O
设KMnO4的质量为x
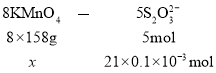
则x=![]()
该KMnO4产品的纯度为![]()
I. ①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol ①
②S(s)+O2(g)=SO2(g) ΔH=-298kJ/mol ②
③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1068kJ/mol ③
(1)将①+③-②得,固体MnO2和二氧化硫气体反应生成MnSO4固体的热化学方程式为MnO2(s)+SO2(g)=MnSO4(s) H=-250KJ· mol -1。答案为:MnO2(s)+SO2(g)=MnSO4(s) H=-250KJ· mol -1;
Ⅱ.(2)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,Mn2+浓度变化由缓慢增大后迅速增大的原因是随着c(Mn2+)的不断增大,反应速率大大加快,生成的Mn2+可能对该反应有催化作用,且c(Mn2+)越大,催化效果越好。答案为:随着c(Mn2+)的不断增大,反应速率大大加快,生成的Mn2+可能对该反应有催化作用,且c(Mn2+)越大,催化效果越好;
Ⅲ.(3)KMnO4是强氧化剂,与其相似的是双氧水和84消毒液。答案为:BC;
(4)①配制500ml0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、量筒、玻璃棒和500mL容量瓶、胶头滴管。答案为:500mL容量瓶、胶头滴管;
②从数据的比较中可以看出,第1组数据为失真数据。后两组数据的平均值为21mL。
滴定过程中发生反应的离子方程式为8MnO4- + 5S2O32- + 14H+ = 10SO42- + 8Mn2+ + 7H2O
设KMnO4的质量为x
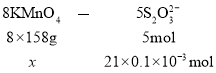
则x=![]()
该KMnO4产品的纯度为![]() =75.8%。答案为:75.8%。
=75.8%。答案为:75.8%。

【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()