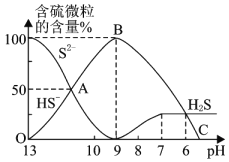
题目内容
【题目】镁带能在CO2中燃烧,生成氧化镁和单质碳。请完成下列填空:
(1)碳元素形成的单质有金刚石、石墨、足球烯等。金刚石的熔点远高于足球烯的原因是_______。
(2)氧化镁的电子式为_______,CO2的结构式为______。与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为______,其1个原子中能量最高的电子有______个。
(3)一定条件下,在容积恒为2.0L的容器中,Fe和CO2发生如下反应:CO2(g)+Fe(s)![]() FeO(s)+CO(g),若起始时向容器中加入1molCO2,5.0min后,容器内气体的相对平均分子量为32,则n(CO2):n(CO)之比为_______,这段时间内用CO2表示的速率v(CO2)=_______。
FeO(s)+CO(g),若起始时向容器中加入1molCO2,5.0min后,容器内气体的相对平均分子量为32,则n(CO2):n(CO)之比为_______,这段时间内用CO2表示的速率v(CO2)=_______。
(4)下列说法错误的是_______。
a.当混合气体的密度不变时说明反应达到了平衡
b.混合气体的平均相对分子质量不变时说明反应达到了平衡
c.平衡后移除二氧化碳时,正反应速率一直减小直至建立新的平衡
d.平衡后缩小容器的体积,正逆反应速率不变,平衡不移动
(5)保持温度不变的情况下,待反应达到平衡后再充入一定量的二氧化碳,平衡向______移动(选填“正向”、“逆向”、或“不”),二氧化碳的转化率_____(填“增大”,“减小”或“不变”)。
【答案】金刚石为原子晶体而足球烯为分子晶体,金刚石中共价键的键能高于足球烯中的分子间作用力,故金刚石的熔点远高于足球烯 ![]() O=C=O 3s23p1 1 1:3 0.075mol/(L·min) c、d 正向 不变
O=C=O 3s23p1 1 1:3 0.075mol/(L·min) c、d 正向 不变
【解析】
(1)金刚石为原子晶体而足球烯为分子晶体,金刚石中共价键的键能高于足球烯中的范德华力;
(2)氧化镁的电子式为![]() ;CO2中碳和氧共用四对电子,所以结构式是O=C=O;第三周期元素中,离子电子层数越少,核电荷数越大,其离子半径越小,所以离子半径最小的是Al3+;
;CO2中碳和氧共用四对电子,所以结构式是O=C=O;第三周期元素中,离子电子层数越少,核电荷数越大,其离子半径越小,所以离子半径最小的是Al3+;
(3)CO2(g)+Fe(s) ![]() FeO(s)+CO(g)是气体体积不变的反应,5.0min后,容器内气体是总物质的量为1mol的CO和CO2混合气体,设CO的物质的量为xmol,CO2的物质的量为(1-x)mol,相对平均分子量为
FeO(s)+CO(g)是气体体积不变的反应,5.0min后,容器内气体是总物质的量为1mol的CO和CO2混合气体,设CO的物质的量为xmol,CO2的物质的量为(1-x)mol,相对平均分子量为![]() =32g/mol,以此解答;
=32g/mol,以此解答;
(4)根据反应到达平衡的特征回答;
(5)待反应达到平衡后再充入一定量的二氧化碳,平衡向正向移动,但到达新平衡时的效果与原平衡等效,故二氧化碳的转化率不变。
(1)金刚石为原子晶体而足球烯为分子晶体,金刚石中共价键的键能高于足球烯中的范德华力,故熔点金刚石大于石墨烯;
(2)氧化镁的电子式为![]() ;CO2中碳和氧共用四对电子,所以结构式是O=C=O;第三周期元素中,离子电子层数越少,核电荷数越大,其离子半径越小,所以离子半径最小的是Al3+,Al原子核外最外层电子数是3且位于第三电子层上,所以Al原子价电子排布式为3s23p1;在含多个电子的原子中,能量最高的电子是离原子核最远的电子,Al原子中能量最高的电子有1个;
;CO2中碳和氧共用四对电子,所以结构式是O=C=O;第三周期元素中,离子电子层数越少,核电荷数越大,其离子半径越小,所以离子半径最小的是Al3+,Al原子核外最外层电子数是3且位于第三电子层上,所以Al原子价电子排布式为3s23p1;在含多个电子的原子中,能量最高的电子是离原子核最远的电子,Al原子中能量最高的电子有1个;
(3)CO2(g)+Fe(s) ![]() FeO(s)+CO(g)是气体体积不变的反应,5.0min后,容器内气体是总物质的量为1mol的CO和CO2混合气体,设CO的物质的量为xmol,CO2的物质的量为(1-x)mol,相对平均分子量为
FeO(s)+CO(g)是气体体积不变的反应,5.0min后,容器内气体是总物质的量为1mol的CO和CO2混合气体,设CO的物质的量为xmol,CO2的物质的量为(1-x)mol,相对平均分子量为![]() =32g/mol,解得x=0.75,则CO的物质的量为0.75mol,CO2的物质的量为0.25mol,n(CO2):n(CO)之比为1:3;这段时间内用CO2表示的速率v(CO2)=
=32g/mol,解得x=0.75,则CO的物质的量为0.75mol,CO2的物质的量为0.25mol,n(CO2):n(CO)之比为1:3;这段时间内用CO2表示的速率v(CO2)= 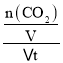 =
=  =0.075mol/(L·min);
=0.075mol/(L·min);
(4)a. CO2(g)+Fe(s) ![]() FeO(s)+CO(g)是气体体积不变的反应,当混合气体的密度不变时说明,混合气体的质量不变,说明应该达到平衡,正确;
FeO(s)+CO(g)是气体体积不变的反应,当混合气体的密度不变时说明,混合气体的质量不变,说明应该达到平衡,正确;
b. CO2(g)+Fe(s) ![]() FeO(s)+CO(g)是气体总物质的量不变的反应,混合气体的平均相对分子质量不变时,混合气体的质量不变,说明应该达到平衡,正确;
FeO(s)+CO(g)是气体总物质的量不变的反应,混合气体的平均相对分子质量不变时,混合气体的质量不变,说明应该达到平衡,正确;
c. 平衡后移除二氧化碳时,正反应速率先减小后增大,直至建立新的平衡,故错误;
d.平衡后缩小容器的体积,正逆反应速率增大,但平衡不移动,故错误;
错误的是c、d;
(5)待反应达到平衡后再充入一定量的二氧化碳,平衡向正向移动,但到达新平衡时的效果与原平衡等效,故二氧化碳的转化率不变;

【题目】某化学小组用下图所列装置(固定装置略)验证CO能还原CuO,并探究其还原产物的组成。
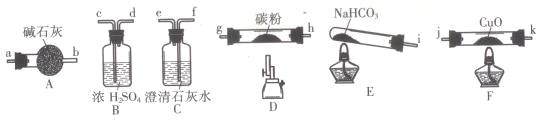
请回答:
(1)按气流方向,各装置从左到右的连接顺序为:
i→______________________________________尾气处理(填仪器接口的字母编号)。
(2)说明CO能还原CuO的实验现象为___________________________。
(3)该实验处理尾气的方法为___________________________。
(4)若去掉B装置,可能产生的影响为___________________________。
(5)将各装置按正确的顺序连接后进行实验。当反应结束后,F处硬质玻璃管中的固体全部变为红色。
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+。
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③________。
[实验验证]该小组为验证上述猜想,分别取少量红色固体放入试管中,进行如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量稀硝酸,振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
b | 加入足量稀硫酸,振荡 | 试管内有红色固体,溶液为无色 |
[实验评价]根据上述实验,不能确定红色固体成分的实验是________(填实验编号),理由为_________(用化学方程式表示)。
[实验结论]根据上述实验结果,可知红色固体的成分为________(填化学式)。
【题目】a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是
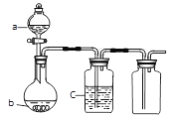
编号 | 气体 | a | b | c |
A | SO2 | 浓H2SO4 | 铜屑 | 饱和Na2SO3溶液 |
B | CO2 | 稀HNO3 | 碳酸钙 | 饱和NaHCO3 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D