题目内容
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL 浓度均为0.100 mol·L-1的NaOH 溶液和氨水溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法错误的是
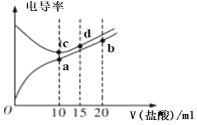
A.滴定氨水的过程应该选择甲基橙作为指示剂
B.a 点溶液中:c(H+)+c(NH4+)-c(OH-)=0.05 mol·L-1
C.b 点溶液中:c(H+)=c(OH-)+c(NH4+)+2c(NH3H2O)
D.a、b、c 三点的溶液中,水的电离程度c> b>a
【答案】D
【解析】
浓度均为0.100 mol·L-1的NaOH 溶液和氨水溶液中,NaOH为强碱,溶液中完全电离,氨水为弱电解质,部分电离,则溶液中的电导能力NaOH大于氨水,则a点所在的曲线为氨水溶液,c点所在的曲线为NaOH溶液;
A. 滴定氨水时,反应的生成物为氯化铵,溶液呈酸性,应该选择甲基橙作为指示剂,A正确;
B. a 点溶液中,溶质恰好为氯化铵根据溶液呈电中性:c(H+)+c(NH4+)=c(Cl-)+c(OH-),此时溶液中c(Cl-)=0.100 mol/L×10mL/20mL=0.05 mol·L-1,B正确;
C. b 点溶液中,盐酸过量,且生成的氯化铵与未反应的HCl的物质的量相等,根据物料守恒可得: c(Cl-)=2 c(NH4+) +2c(NH3H2O),根据溶液呈电中性:c(H+)+c(NH4+)=c(Cl-)+c(OH-),代入,消除c(Cl-)即可得到,C正确;
D. 酸与碱溶液对水的电离均有抑制作用,生成的氯化铵的水的电离有促进作用,a点为氯化铵、b点盐酸过量、c 点位氯化钠,则三点的溶液中,水的电离程度a >c> b,D错误;
答案为D

 阅读快车系列答案
阅读快车系列答案【题目】完成下列填空:
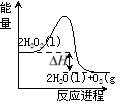
(1)下图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,写出N2和H2反应的热化学方程式:____________________.

(2)若已知下列数据:试根据表中及图中数据计算N-H的键能____________kJ·mol-1.
化学键 | H-H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1___________,E2 _________ (填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如4NH3(g)+3O2(g)=2N2(g)+6H2O(g);ΔH1= a kJ·mol-1N2(g)+O2(g)=2NO(g);ΔH2=b kJ/mol若1mol NH3还原NO至N2,写出该反应的热化学方程式__________(ΔH用a、b表示).