题目内容
Na2SO3、SO2是中学常见的物质。
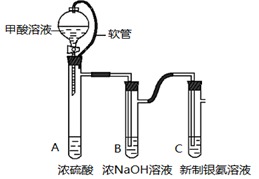
(1)某同学用下图示装置制取干燥纯净的SO2。
写出制取SO2气体的化学方程式 。请指出D装置中的错误 。若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是 。
(2)向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色。反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告。限选试剂:2 mol/LHCl,1 mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1 mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色。 | ,证明待测液中含Br-。 |
| 步骤② | 在试管B中加入少量待测液, | 有白色沉淀生成, 证明待测液中含SO42-。 |
| 步骤③ | 在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴______(填试剂),振荡。 | , 证明待测液中含SO32-。 |
(1)Cu + 2H2SO4 CuSO4 + SO2↑+ 2H2O(2分) 进气管比出气管短(2分)
CuSO4 + SO2↑+ 2H2O(2分) 进气管比出气管短(2分)
立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液 (2分)
(2)编号 实验操作 预期现象和结论 步骤① 溶液分层,下层呈橙红色(2分) 步骤② 加入过量的2mol/L盐酸,再滴加1mol/L BaCl2溶液(2分) 步骤③ 新制饱和溴水(2分) 溴水褪色(2分)
解析试题分析:(1)根据题给装置图分析,制取SO2气体的原理是铜和浓硫酸共热生成硫酸铜、二氧化硫和水,化学方程式为Cu + 2H2SO4 CuSO4 + SO2↑+ 2H2O;D装置为二氧化硫的收集装置,二氧化硫的密度比空气大,应用向上排空气法收集,装置中的错误是进气管比出气管短;若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液;(2)鉴定混合液中的SO32-、SO42-和Br-离子,根据题给试剂设计实验方案。①取少量待测液于试管A中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色,溴溶解在四氯化碳中,下层为橙红色,说明含Br-,②取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液,观察到白色沉淀的生成,说明含SO42-;③在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴新制溴水,振荡,新制饱和溴水与亚硫酸根离子的氧化还原反应,观察溴水褪色,说明含SO32-。
CuSO4 + SO2↑+ 2H2O;D装置为二氧化硫的收集装置,二氧化硫的密度比空气大,应用向上排空气法收集,装置中的错误是进气管比出气管短;若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液;(2)鉴定混合液中的SO32-、SO42-和Br-离子,根据题给试剂设计实验方案。①取少量待测液于试管A中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色,溴溶解在四氯化碳中,下层为橙红色,说明含Br-,②取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液,观察到白色沉淀的生成,说明含SO42-;③在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴新制溴水,振荡,新制饱和溴水与亚硫酸根离子的氧化还原反应,观察溴水褪色,说明含SO32-。
考点:考查二氧化硫的实验室制备及离子检验。

 新思维寒假作业系列答案
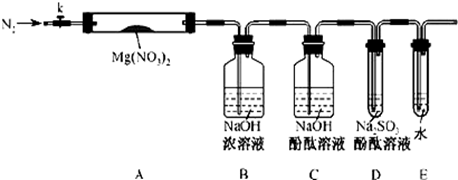
新思维寒假作业系列答案乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45 °C,沸点:180.8℃,它是有机合成中常用的原料。在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为:2CH3COOC2H5  CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题。
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| | 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138. 4 | 76.8 |
最好选用 来熔化钠。是否能用四氯化碳? (填“是”或“否”)理由是 。
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管。缓缓加热,保持瓶中混合液微沸状态。在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是 。烧瓶配上长导管的作用是 ,导管上端接一干燥管的目的是 。
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是 ,写出步骤⑦实验操作的主要仪器 (填最主要一种)。
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品。

(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是 。
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示。冷凝管的进出水方向应 口进, 口出。毛细管的作用是 。

某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20ml甲醇(密度约0.79g·mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。‘
(1)浓硫酸的作用是 ;
|
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称。操作Ⅰ 操作Ⅱ 。
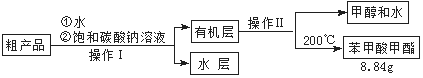
(4)能否用NaOH溶液代替饱和碳酸钠溶液? (填“能”或“否”),
并简述原因 。
(5)通过计算,苯甲酸甲酯的产率是 。
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
NaBr + H2SO4 → NaHSO4 + HBr
CH3CH2OH + HBr CH3CH2Br + H2O
CH3CH2Br + H2O
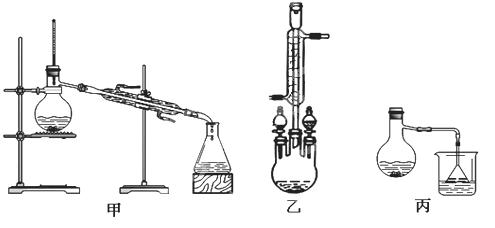
某课外小组欲在实验室制备溴乙烷的装置如右图。数据如下表。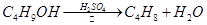
| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g·cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
请回答下列问题。
(1)加入药品之前须做的操作是:_________________,实验进行的途中若发现未加入碎瓷片,其处理的方法是__________________。
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是_____________。温度计的温度应控制在_____________之间。
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是___________,______________,此操作可在___________(填写玻璃仪器名称)中进行,同时进行分离。
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了_______________________。
(5)粗产品中含有的主要有机液体杂质是_____________,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行______________操作。