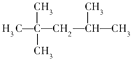��Ŀ����
����Ŀ����֪������ʵ��
�� Cr2O3����KOH��Һ�õ�KCrO2��Һ��Cr2O3����������Һ�õ�Cr2(SO4)3��Һ��
�� ��KCrO2��Һ�еμ�H2O2��Һ�����ữ���ɵ�K2Cr2O7��Һ��
�� ��K2Cr2O7��Һ�μӵ�����-KI��Һ�У���Һ������������������ȷ����
A. ʵ���֤��Cr2O3������������
B. ʵ�����H2O2����������K2Cr2O7����������
C. ʵ���֤�������ԣ�Cr2O72->I-
D. ʵ����У�������1.27gI2����Ӧ��ת��0.01mol����
���𰸡�C
��������A���ɷ�Ӧ�ٿ�֪�����������ᡢ�Ӧ�����κ�ˮ��Ϊ�����������A��ȷ��B��ʵ�����CrԪ�صĻ��ϼ���+3������Ϊ+6�ۣ������������OԪ�صĻ��ϼ۽��ͣ�˵��H2O2����������K2Cr2O7�����������B��ȷ��C���ɢ�����Һ���������ɵⵥ�ʿ�֪�� CrԪ�صĻ��ϼ۽��ͣ�K2Cr2O7����������IԪ�صĻ��ϼ����ߣ�KI�ǻ�ԭ�������������������Դ�����������������Կ�֪��������ΪCr2O72-��I2��������û�������ԣ���C����D. 1.27gI2�����ʵ���Ϊ![]() =0.005mol��ʵ�����IԪ�صĻ��ϼ���-1�����ߵ�0�ۣ���Ӧ��ת��0.005mol ��2=0.01mol����D��ȷ����ѡC��
=0.005mol��ʵ�����IԪ�صĻ��ϼ���-1�����ߵ�0�ۣ���Ӧ��ת��0.005mol ��2=0.01mol����D��ȷ����ѡC��

 ��ǰ����ϵ�д�
��ǰ����ϵ�д�