题目内容
【题目】某原电池结构如图所示,下列有关该原电池的说法正确的是
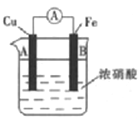
A. 铁作负极
B. 放电过程中,电子的转移方向:Cu电极→浓硝酸→Fe电极
C. 该原电池正极的电极反应式为2H++e-+NO3-=H2O+NO2↑
D. 放电过程中, NO3-向B端移动
【答案】C
【解析】常温下Fe与浓硝酸发生钝化形成致密的氧化膜,该原电池中自发的氧化还原反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,则该原电池中Cu为负极,Fe为正极。A项,铁为正极,错误;B项,放电过程中,电子的转移方向:Cu电极→导线→Fe电极,错误;C项,正极的电极反应式为2H++e-+NO3-=H2O+NO2↑,正确;D项,放电过程中,NO3-向负极移动,向A端移动,错误;答案选C。

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目