题目内容
【题目】羰基硫(COS)在常温常压下为有臭鸡蛋气味的无色气体,广泛应用于农药、医药和其他化工生产中,存在于煤、石油和天然气中的羰基硫会腐蚀设备、污染环境,更会危害人体健康,工业上处理羰基硫常见的方法有水解反应和氢解反应。
(1)已知羰基硫中所有原子最外层均达到8电子结构,则其结构式为________________。
(2)①已知:H2(g)+COS(g)![]() H2S(g)+CO(g)△H1=+6.2kJ·mol-1;
H2S(g)+CO(g)△H1=+6.2kJ·mol-1;
②H2(g)+CO2(g)![]() H2O(g)+CO(g)△H2=+41.2kJ·mol-1;
H2O(g)+CO(g)△H2=+41.2kJ·mol-1;
则COS水解反应的热化学方程式为H2O(g)+COS(g)=H2S(g)+CO2(g),△H=___________kJ/mol.
②已知:COS水解反应的机理如下,其中吸附在催化剂表面的物种用*标注。
a. 吸附:H2O→H2O*
b. 反应:COS+H2O*→CO2+H2S*
c. 脱附:H2S*→H2S
已知COS水解反应的反应速率由b决定,则a、b、c三步中活化能最大的是__________________。
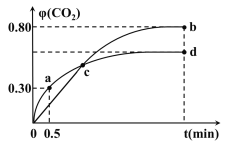
(3)已知COS氢解反应的热化学方程式为H2(g)+COS(g)![]() H2S(g)+CO(g) △H=+6.2kJ·mol-1,一定温度下,向某恒容密闭容器中充入4molCOS(g)和6molH2(g)发生氢解反应,H2、COS的体积分数
H2S(g)+CO(g) △H=+6.2kJ·mol-1,一定温度下,向某恒容密闭容器中充入4molCOS(g)和6molH2(g)发生氢解反应,H2、COS的体积分数![]() 随时间变化的关系如图所示,
随时间变化的关系如图所示,
①H2的平衡转化率为_________________,
②该温度下,反应的平衡常数K为__________________,
③其他条件不变,20min时,向该容器中充入2molH2和3molCO,此时v(正)______________v(逆)(填“大于”“小于”或“等于”)。
【答案】O=C=S -35.0 b 60% 13.5 等于
【解析】
(2)根据盖斯定律进行计算;
②化学反应的反应速率由反应速率最慢的一步决定,且反应的活化能越大,反应速率越慢;
(3)根据已知信息和反应的特点,列三段式进行计算。
(1)已知羰基硫中所有原子最外层均达到8电子结构,类比CO2,可知其结构式为O=C=S;
(2)已知热化学方程式:①H2(g)+COS(g)![]() H2S(g)+CO(g)△H1=+6.2kJ·mol-1;②H2(g)+CO2(g)
H2S(g)+CO(g)△H1=+6.2kJ·mol-1;②H2(g)+CO2(g)![]() H2O(g)+CO(g)△H2=+41.2kJ·mol-1;根据盖斯定律可知,由①-②可得目标方程式,则COS水解反应的热化学方程式为H2O(g)+COS(g)=H2S(g)+CO2(g) △H=△H1-△H2=+6.2kJ·mol-1 - 41.2kJ·mol-1= -35.0kJ/mol;
H2O(g)+CO(g)△H2=+41.2kJ·mol-1;根据盖斯定律可知,由①-②可得目标方程式,则COS水解反应的热化学方程式为H2O(g)+COS(g)=H2S(g)+CO2(g) △H=△H1-△H2=+6.2kJ·mol-1 - 41.2kJ·mol-1= -35.0kJ/mol;
②已知COS水解反应的反应速率由b决定,则步骤b的反应速率最慢,则a、b、c三步中活化能最大的是b;
(3)该反应前后气体物质的量不变,则气体总物质的量始终为10mol,由图像可知,达到平衡状态时,H2(g)的体积分数为24%,则平衡时,H2(g)的物质的量为2.4mol,则H2(g)的转化量为3.6mol,
①则H2的平衡转化率为![]() ;
;
②可列出三段式为(单位为mol):
 ,因为该反应前后气体物质的量不变,故该温度下,反应的平衡常数
,因为该反应前后气体物质的量不变,故该温度下,反应的平衡常数![]() ;
;
③其他条件不变,20min时,向该容器中充入2molH2和3molCO,此时n(H2)=4.4mol,n(CO)=6.6mol,则浓度商![]() ,故反应处于平衡状态,则v(正)等于v(逆)。
,故反应处于平衡状态,则v(正)等于v(逆)。