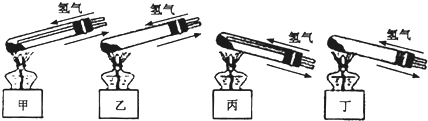
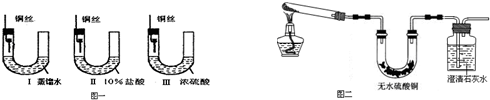
题目内容
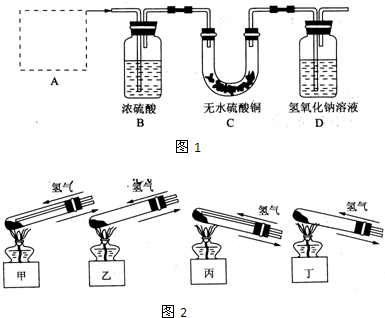
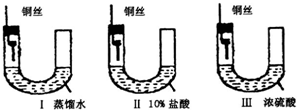
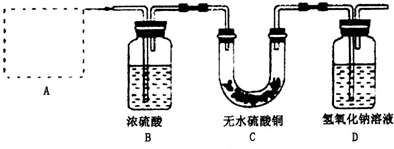
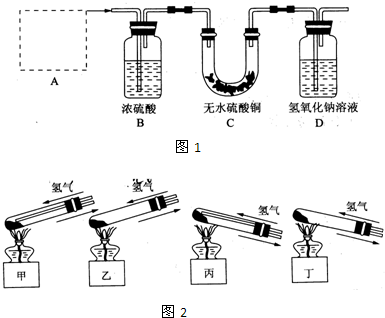
Ⅰ、铜器长期暴露在潮湿空气中,它的表层往往含有“铜绿”(碱式碳酸铜),它受热易分解,为了从铜绿中制得铜,并测定铜绿在混合物中的质量分数,把铜绿样品放在试管中,与通入的纯净氢气在加热条件下发生反应,实验装置如图1,请回答下列有关问题.(1)A处应选用图2装置中的(填写编号)______(铁架台已省去),选用的理由是①______;②通入氢气的导气管应伸入到试管底部,有利于将试管中的空气排净.
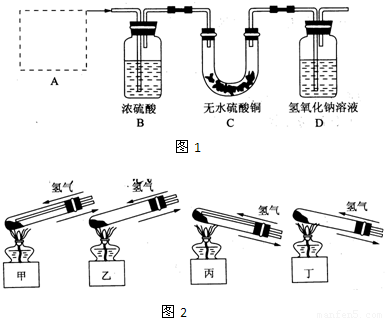
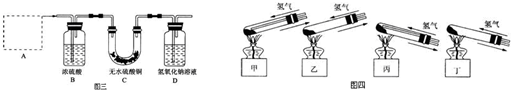
(2)反应开始前,对整个实验装置必须进行的操作是称量样品质量、检查装置的气密性和______;反应进行时,应先______再______;实验过程中,观察到试管中固体颜色变化为______.
(3)要测定铜绿在混合物中的质量分数,除需要知道样品质量外还需测定的实验数据是实验前后装置D质量.
(4)为使实验更准确,可采取的措施是______.
Ⅱ、10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则______(填“甲”或“乙”)判断正确.试剂X是______(填序号).
A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则______(填“甲”或“乙”)判断正确.
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言______(填“甲”或“乙”)判断是错误的,理由是______.
【答案】分析:Ⅰ(1)①固体加热分解装置中的大试管要向下倾斜,并且氢气通入到药品的上方位置,将空气排净;
(2)需要根据D装置的质量差计算生成的二氧化碳的量;反应进行时,应先通气体再点灯,防止空气的干扰;碱式碳酸铜加热分解成黑色的氧化铜,氢气将氧化铜还原成单质铜;
(4)空气中的二氧化碳加热D装置,会影响装置D的质量;
Ⅱ甲:碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性;碳酸钠是强碱弱酸盐能水解,且碳酸钠的水解程度大于碳酸氢钠的水解程度,
(1)碳酸氢钠和氯化钡不反应,但碳酸钠和氯化钡能反应生成白色沉淀碳酸钡;
(2)若加热后碳酸氢钠不分解,溶液仍然是碳酸氢钠溶液,温度不变溶液的pH值也不变;
(3)碳酸氢钠的分解温度是150℃,加热溶液时溶液的温度达不到该温度,据此分析判断.
解答:解:I、(1)给试管中的固体加热时,为了防止冷凝水倒流入试管底,使试管骤然遇冷而炸裂,大试管的管口应略向下倾斜,并且氢气通入到药品的上方位置,
故答案为:丙;
①选用丙的原因是:因反应有水生成,试管口应略低于试管底部,防止冷凝水倒流到试管底部而使试管炸裂;通入氢气的导气管应伸入到试管底部,有利于将试管中的空气排净,
故答案为:因反应有水生成,试管口应略低于试管底部,防止冷凝水倒流到试管底部而使试管炸裂;
(2)原因通过D装置的质量差计算生成的二氧化碳的质量,所以实验前需要称量装置D的质量;反应进行时,为了防止空气的干扰,应先通氢气再点燃酒精灯;实验过程中,观察到试管中固体原先是绿色,加热后变成黑色的氧化铜,之后被氢气还原成红色的铜单质,
故答案为:称量装置D(含氢氧化钠溶液)的质量; 通入氢气; 加热;固体由绿色变黑色,最后变成光亮的红色;
(4)原因装置D直接和空气接触,会吸收空气中的二氧化碳,影响测定结果,所以应该在D装置后加一个盛有碱石灰的球形干燥管,
故答案为:在D装置后加一个盛有碱石灰的球形干燥管;
II、甲:碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性,水解方程式为HCO3-+H2O?H2CO3+OH-;碳酸钠是强碱弱酸盐能水解,碳酸是二元弱酸,第一步电离程度远远大于第二步电离,所以碳酸根离子的第一步水解程度远远大于第二步水解程度,导致碳酸钠的水解程度大于碳酸氢钠的水解程度,
故答案为:HCO3-+H2O?H2CO3+OH-;大于;
(1)碳酸氢钠和氯化钡不反应,但碳酸钠和氯化钡能反应生成白色沉淀碳酸钡 Na2CO3+BaCl2=BaCO3↓+2NaCl,向碳酸钠或碳酸氢钠溶液中加入氢氧化钡或氢氧化钙都生成白色沉淀,向碳酸钠溶液或碳酸氢钠溶液中加入氢氧化钠都不产生明显现象,故选B.
故答案为:乙;B;
(2)若加热后碳酸氢钠不分解,溶液仍然是碳酸氢钠溶液,温度不变溶液的PH值也不变,由此证明甲是正确的,
故答案为:甲;
(3)碳酸氢钠的分解温度是150℃,常压下加热NaHCO3的水溶液,溶液的温度达不到150℃,所以碳酸氢钠不分解,溶液仍然是碳酸氢钠溶液,由此判断乙是错误的,
故答案为:乙; 常压下加热NaHCO3的水溶液,溶液的温度达不到150℃.
点评:本题考查了金属铜的腐蚀以及金属铜的化学性质、碳酸氢钠的性质,结合试验进行了考察,注意常压下加热碳酸氢钠固体和碳酸氢钠溶液的区别,加热固体时易分解生成碳酸钠、水和二氧化碳,但加热碳酸氢钠溶液时,碳酸氢钠不分解,本题难度中等.
(2)需要根据D装置的质量差计算生成的二氧化碳的量;反应进行时,应先通气体再点灯,防止空气的干扰;碱式碳酸铜加热分解成黑色的氧化铜,氢气将氧化铜还原成单质铜;
(4)空气中的二氧化碳加热D装置,会影响装置D的质量;
Ⅱ甲:碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性;碳酸钠是强碱弱酸盐能水解,且碳酸钠的水解程度大于碳酸氢钠的水解程度,
(1)碳酸氢钠和氯化钡不反应,但碳酸钠和氯化钡能反应生成白色沉淀碳酸钡;
(2)若加热后碳酸氢钠不分解,溶液仍然是碳酸氢钠溶液,温度不变溶液的pH值也不变;
(3)碳酸氢钠的分解温度是150℃,加热溶液时溶液的温度达不到该温度,据此分析判断.
解答:解:I、(1)给试管中的固体加热时,为了防止冷凝水倒流入试管底,使试管骤然遇冷而炸裂,大试管的管口应略向下倾斜,并且氢气通入到药品的上方位置,
故答案为:丙;
①选用丙的原因是:因反应有水生成,试管口应略低于试管底部,防止冷凝水倒流到试管底部而使试管炸裂;通入氢气的导气管应伸入到试管底部,有利于将试管中的空气排净,
故答案为:因反应有水生成,试管口应略低于试管底部,防止冷凝水倒流到试管底部而使试管炸裂;
(2)原因通过D装置的质量差计算生成的二氧化碳的质量,所以实验前需要称量装置D的质量;反应进行时,为了防止空气的干扰,应先通氢气再点燃酒精灯;实验过程中,观察到试管中固体原先是绿色,加热后变成黑色的氧化铜,之后被氢气还原成红色的铜单质,
故答案为:称量装置D(含氢氧化钠溶液)的质量; 通入氢气; 加热;固体由绿色变黑色,最后变成光亮的红色;
(4)原因装置D直接和空气接触,会吸收空气中的二氧化碳,影响测定结果,所以应该在D装置后加一个盛有碱石灰的球形干燥管,
故答案为:在D装置后加一个盛有碱石灰的球形干燥管;
II、甲:碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性,水解方程式为HCO3-+H2O?H2CO3+OH-;碳酸钠是强碱弱酸盐能水解,碳酸是二元弱酸,第一步电离程度远远大于第二步电离,所以碳酸根离子的第一步水解程度远远大于第二步水解程度,导致碳酸钠的水解程度大于碳酸氢钠的水解程度,
故答案为:HCO3-+H2O?H2CO3+OH-;大于;
(1)碳酸氢钠和氯化钡不反应,但碳酸钠和氯化钡能反应生成白色沉淀碳酸钡 Na2CO3+BaCl2=BaCO3↓+2NaCl,向碳酸钠或碳酸氢钠溶液中加入氢氧化钡或氢氧化钙都生成白色沉淀,向碳酸钠溶液或碳酸氢钠溶液中加入氢氧化钠都不产生明显现象,故选B.
故答案为:乙;B;
(2)若加热后碳酸氢钠不分解,溶液仍然是碳酸氢钠溶液,温度不变溶液的PH值也不变,由此证明甲是正确的,
故答案为:甲;
(3)碳酸氢钠的分解温度是150℃,常压下加热NaHCO3的水溶液,溶液的温度达不到150℃,所以碳酸氢钠不分解,溶液仍然是碳酸氢钠溶液,由此判断乙是错误的,
故答案为:乙; 常压下加热NaHCO3的水溶液,溶液的温度达不到150℃.
点评:本题考查了金属铜的腐蚀以及金属铜的化学性质、碳酸氢钠的性质,结合试验进行了考察,注意常压下加热碳酸氢钠固体和碳酸氢钠溶液的区别,加热固体时易分解生成碳酸钠、水和二氧化碳,但加热碳酸氢钠溶液时,碳酸氢钠不分解,本题难度中等.

练习册系列答案
相关题目
Ⅰ、铜器长期暴露在潮湿空气中,它的表层往往含有“铜绿”(碱式碳酸铜),它受热易分解,为了从铜绿中制得铜,并测定铜绿在混合物中的质量分数,把铜绿样品放在试管中,与通入的纯净氢气在加热条件下发生反应,实验装置如图1,请回答下列有关问题.
(1)A处应选用图2装置中的(填写编号)______(铁架台已省去),选用的理由是①______;②通入氢气的导气管应伸入到试管底部,有利于将试管中的空气排净.
(2)反应开始前,对整个实验装置必须进行的操作是称量样品质量、检查装置的气密性和______;反应进行时,应先______再______;实验过程中,观察到试管中固体颜色变化为______.
(3)要测定铜绿在混合物中的质量分数,除需要知道样品质量外还需测定的实验数据是实验前后装置D质量.
(4)为使实验更准确,可采取的措施是______.
Ⅱ、10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则______(填“甲”或“乙”)判断正确.试剂X是______(填序号).
A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则______(填“甲”或“乙”)判断正确.
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言______(填“甲”或“乙”)判断是错误的,理由是______.