��Ŀ����
����Ŀ������ش�
��1��Na2O2�ĵ���ʽ ��
��2����ȥFeCl3������FeCl2�����ӹ����漰�Ļ�ѧ��Ӧ����ʽ ��
��3��������Na2CO3��Һ��ͨ��CO2���壬��Һ�г��ְ�ɫ���ǣ�д���÷�Ӧ�����ӷ���ʽ ��
��4��˫��ˮ��ʹ���Ը��������Һ��ɫ�������������ط�Ӧ�����ӷ���ʽ��
�� ��MnO4������ ��H2O2�� ���� ��Mn2+���� ��H2O�� ��
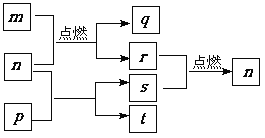
����������A ��NaH������Ҫ�Ļ�ԭ������ˮ��ǿ�ҷ�Ӧ��һ�������£�2.40g NaH������B��Ӧ����3.90g������A�� 2.24L��������ɱ�״������H2����֪����B��ʹʪ���ɫʯ����ֽ��������֪��NH3+ NH3��NH4++NH2-
��ش��������⣺
��1��A�Ļ�ѧʽ�� ��
��2��A���������ᷢ����������ԭ��Ӧ�Ļ�ѧ����ʽ ��
��3���ڸ������⻯�ƣ�NaH���ɽ����Ȼ��ѣ�TiC14����ԭ�ɽ����ѣ��÷�Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡�
��1��![]()
��2��2FeCl2+Cl2=2FeCl3
��3��2Na++CO32��+CO2+H2O==2NaHCO3��
��4��2MnO4����5H2O2��6H+==2Mn2+��8H2O��5O2��
��1��NaNH2
��2��NaNH2+2HCl=NaCl+NH4Cl
��3��2NaH+TiCl4![]() Ti+2NaCl+2HCl����4NaH+TiCl4
Ti+2NaCl+2HCl����4NaH+TiCl4![]() Ti+4NaCl+2H2��
Ti+4NaCl+2H2��
��������
�����������1��Na2O2�������Ӻ��������ӹ��ɵ����ӻ����������ʧ�����γ������ӣ����������ӵõ������γ������ӣ�����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��2��FeCl2����Cl2��Ӧ����FeCl3����ȥ����Ӧ�����ӷ���ʽΪ2FeCl2+Cl2=2FeCl3���ʴ�Ϊ2FeCl2+Cl2=2FeCl3��
��3��̼���ƺͶ�����̼��ˮ��Ӧ����̼�����ƣ�̼�����Ƶ��ܽ��С��̼���ƣ�����������Na2CO3��Һ��ͨ��CO2���壬��Һ�г��ְ�ɫ���ǣ�2Na++CO32��+CO2+H2O == 2NaHCO3��
��4��˫��ˮ��ʹ���Ը��������Һ��ɫ�����ݵ����غ㡢Ԫ���غ㣬��Ӧ�����ӷ���ʽΪ��
2MnO4����5H2O2��6H+ == 2Mn2+��8H2O��5O2����
��B��ʹʪ���ɫʯ����ֽ����������BΪ���������ݵ����غ㣬�μӷ�Ӧ�İ���Ϊ0.1mol������Ԫ���غ㣬A�к���0.1mol��Naԭ�ӡ�0.1mol��Nԭ�ӣ�B������Ϊ3.90g������A�л���0.2mol����ԭ�ӣ���1��A�Ļ�ѧʽ��NaNH2��
��2��NaNH2���������ᷢ����������ԭ��Ӧ�����Ȼ��ƺ��Ȼ�泥�����ʽNaNH2 +2HCl =NaCl + NH4Cl ��
��3���ڸ������⻯�ƣ�NaH���ɽ����Ȼ��ѣ�TiC14����ԭ�ɽ����ѣ��÷�Ӧ�Ļ�ѧ����ʽΪ4NaH+TiCl 4 ![]() Ti+4NaCl+2H 2 ����
Ti+4NaCl+2H 2 ����

 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д�