题目内容
(1) 甲烷的分子个数为1.204×1023,则甲烷的物质的量为 mol,所含的原子个数共有 个,与这些甲烷质量相等的O2的物质的量为 mol。
(2)含有相同氧原子数目的NO和CO2两种气体,其质量比 ,物质的量比为 ,在标准状态下,体积比为 。
(3)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol。
①原NaOH溶液的质量分数为 。
②所得溶液中Cl-的物质的量为 mol。
③所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)= 。
(2)含有相同氧原子数目的NO和CO2两种气体,其质量比 ,物质的量比为 ,在标准状态下,体积比为 。
(3)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol。
①原NaOH溶液的质量分数为 。
②所得溶液中Cl-的物质的量为 mol。
③所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)= 。
(1)0.2 ; NA或6.02×1023; 0.1(1+1+1=3分)
(2)15︰11; 2︰1; 2︰1 (1+1+1=3分)
(3)①10.71% (2分) ②0.25 mol (2分) ③3︰2(2分)
试题分析:(1)n=N/NA=1.204×1023/6.02×1023=0.2mol;N=0.2×5NA=NA;n(O2)=0.2×16÷32=0.1mol
(2)15︰11; 2︰1; 2︰1
(3)该过程发生两个反应为HCl+NaOH=NaCl+H2O,Cl2+2NaOH=NaCl+NaClO+H2O。
①原NaOH溶液的质量分数w="0.1L×3.00" mol/L×40g/mol÷(100 mL×1.12g/mL)=10.71%
②根据钠原子守恒知n(Cl-)=n(NaOH)-n(NaClO)=0.3-0.05=0.25mol
③剩余氯气的量为n(Cl2)=n(NaClO)=0.05mol,
反应生成的n(HCl)=n(Cl-)-n(Cl2)反应=0.25-0.05=0.2mol
反应的氯气和氢气的量为n(Cl2)=n(H2)=n(HCl)/2=0.2÷2=0.1mol
所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=(0.1+0.05)∶0.1=3︰2

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
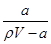 ×100%
×100%  mol·L-1
mol·L-1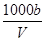 mol·L-1+c(H+)
mol·L-1+c(H+)