题目内容
20g由两种金属粉末组成的混合物,与足量的盐酸充分反应后得到11.2L氢气(标准状况),这种金属混合物的组成可能是
| A.Mg和Al | B.Al和Fe |
| C.Fe和Zn | D.Zn和Cu |
B
11.2L氢气的物质的量为0.5mol,假设均为+2价金属与盐酸反应生成,则+2价金属的总物质的量为0.5mol,所以+2价金属的平均摩尔质量为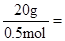 40g·mol-1。因为为两种金属的混合物,则其摩尔质量应一个比40g·mol-1大,一个比40g·mol-1小;比较选项中各金属的相对原子质量可以得出答案为B(其中Al作为+2价时其摩尔质量为27×
40g·mol-1。因为为两种金属的混合物,则其摩尔质量应一个比40g·mol-1大,一个比40g·mol-1小;比较选项中各金属的相对原子质量可以得出答案为B(其中Al作为+2价时其摩尔质量为27×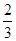 =18g·mol-1;铜等不反应的金属的摩尔质量为无穷大)。
=18g·mol-1;铜等不反应的金属的摩尔质量为无穷大)。
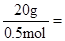 40g·mol-1。因为为两种金属的混合物,则其摩尔质量应一个比40g·mol-1大,一个比40g·mol-1小;比较选项中各金属的相对原子质量可以得出答案为B(其中Al作为+2价时其摩尔质量为27×
40g·mol-1。因为为两种金属的混合物,则其摩尔质量应一个比40g·mol-1大,一个比40g·mol-1小;比较选项中各金属的相对原子质量可以得出答案为B(其中Al作为+2价时其摩尔质量为27×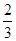 =18g·mol-1;铜等不反应的金属的摩尔质量为无穷大)。
=18g·mol-1;铜等不反应的金属的摩尔质量为无穷大)。
练习册系列答案
相关题目

