题目内容
【题目】三草酸合铁(Ⅲ)酸钾是制备负载活性催化剂的主要原料。加热至110℃时失去结晶水,230℃时分解。极易感光,室温下光照变为黄色:
2K3[Fe(C2O4)3]·3H2O![]() 2FeC2O4·2H2O+3K2C2O4+2CO2↑+2H2O
2FeC2O4·2H2O+3K2C2O4+2CO2↑+2H2O
已知:
物质名称 | 化学式 | 相对分子质量 | 颜色 | 溶解性 |
三草酸合铁(Ⅲ)酸钾 | K3[Fe(C2O4)3]·3H2O | 491 | 翠绿色 | 可溶于水,难溶于乙醇 |
草酸亚铁 | FeC2O4·2H2O | 180 | 黄色 | 难溶于水,可溶于酸 |
某同学对三草酸合铁(Ⅲ)酸钾的制备及组成进行了实验探究。回答下列问题:
(一)三草酸合铁(Ⅲ)酸钾的制备
(ⅰ)称取4.50 g FeC2O4·2H2O固体,加入饱和K2C2O4溶液中,用滴管慢慢加入3% H2O2溶液,不断搅拌,并保持温度在40℃左右。充分反应后,沉淀转化为氧氧化铁。
(ⅱ)加热至沸腾,滴加1mol 的草酸溶液至沉淀溶解。用草酸或草酸钾调节溶液pH=4-5
(ⅲ)小火加热浓缩,冷却结晶,过滤,先用少量冰水洗涤,再用无水乙醇洗涤,低温干燥后称量,得到9.80g 翠绿色晶体。
(1)完成步骤(i)发生反应的离子方程式:
____FeC2O4·2H2O+______C2O42-+____H2O2=___Fe(OH)3+4[Fe(C2O4)3]3-+____H2O
(2)步骤(ⅲ)中,用无水乙醇洗涤晶体的目的是________。
(3)列式计算本实验中三草酸合铁(Ⅲ)酸钾的产率______________。
(二)草酸根含量侧定
准确称取4.80g 三草酸合铁(Ⅲ)酸钾样品,配制成250mL 溶液。量取25.00 mL 溶液置于锥形瓶中,加入5.0 mL 1mol/L H2SO4,用0.06mol/L的KMnO4 溶液滴定。滴定终点时消耗KMnO4溶液20.00mL。
(4)滴定过程中,盛放高锰酸钾溶液的仪器名称是_______________,滴定时发生反应的离子方程式为_____。
(5)样品中草酸根的物质的量为_______;若该数值大于4.80g二草酸合铁(Ⅲ)酸钾纯品中草酸根的物质的量,其原因可能是_______(填字母)。
a.制取过程中草酸或草酸钾用量过多
b.样品未完全干燥
c.滴定时盛放KMnO4溶液的仪器未用标准液润洗
d.锥形瓶洗净后未烘干
(三)某同学制得的三草酸合铁(Ⅲ)酸钾,晶体表面发黄,推测可能有部分晶体发生了分解。
(6)为了验证此推测是否正确,可选用的试剂是____________。
【答案】 6 6 3 2 12 除去晶体表面的水分 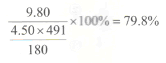 酸式滴定管 5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O或
酸式滴定管 5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O或
5[Fe(C2O4)3]3-+6MnO4-+48H+=30CO2↑+6Mn2++24H2O+5Fe3+ 0.03mol ac 酸化的K3[Fe(CN)6](铁氰化钾)溶液(1分,只答铁氰化钾也得分)(铁氰化钾也可写成铁(Ⅲ)氰化钾)
【解析】试题分析:(1)根据化合价升降规律、电荷守恒、元素守恒配平方程式;(2)乙醇易挥发,三草酸合铁(Ⅲ)酸钾难溶于无水乙醇; (3)根据铁元素守恒,利用关系式计算产率;(4)高锰酸钾溶液盛放在酸式滴定管中,滴定时草酸根离子被氧化为二氧化碳;根据消耗高锰酸钾的物质的量计算草酸根的物质的量;(6)表面发黄,可能生成FeC2O4,需要检验亚铁离子;
解析:根据化合价升降规律、电荷守恒、元素守恒配平离子方程式为6FeC2O4·2H2O+6C2O42-+3H2O2=2Fe(OH)3+4[Fe(C2O4)3]3-+12H2O;(2)三草酸合铁(Ⅲ)酸钾难溶于无水乙醇,乙醇易挥发,用乙醇除去晶体表面的水分;(3)铁元素守恒,设三草酸合铁(Ⅲ)酸钾理论产量为xg,根据关系式
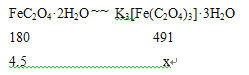
X= ![]() ,所以产率为
,所以产率为![]()
![]() =79.8%。(4)高锰酸钾溶液盛放在酸式滴定管中,滴定时草酸根离子被氧化为二氧化碳,反应方程式为5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O;(5)设草酸根的物质的量为x mol,
=79.8%。(4)高锰酸钾溶液盛放在酸式滴定管中,滴定时草酸根离子被氧化为二氧化碳,反应方程式为5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O;(5)设草酸根的物质的量为x mol,
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
5 2
X 0.06mol/L![]()
![]() ,x=0.03mol;
,x=0.03mol;
制取过程中草酸或草酸钾用量过多,会使草酸根离子偏多,故a正确;
b.样品未完全干燥,会使草酸根离子偏少,故b错误;
c.滴定时盛放KMnO4溶液的仪器未用标准液润洗,会消耗高锰酸钾偏多,使草酸根离子偏多,故c正确;
d.锥形瓶洗净后未烘干,无影响,故d错误;(6)表面发黄,可能生成FeC2O4,需要检验亚铁离子,加入酸化的K3[Fe(CN)6](铁氰化钾)溶液,若变蓝色,则含有亚铁离子。