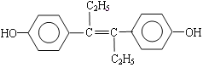
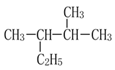题目内容
【题目】常温下,向20.00mL0.1000 mol·L-1的醋酸溶液中逐滴加入0.1000 mol·L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示。下列说法不正确的是

A. 在反应过程中,c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)
B. pH=5时,c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
C. pH=7时,消耗NaOH溶液的体积肯定小于20.00mL
D. pH>7时,消耗NaOH溶液的体积肯定大于20.00mL
【答案】D
【解析】A、反应过程中一定遵循电荷守恒,即c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A说法正确;B、pH=5溶液显酸性,说明溶液中的溶质为CH3COONa和CH3COOH,根据图像,当pH=5时,消耗的NaOH的体积在10~20之间,说明CH3COOH的物质的量大于CH3COONa,CH3COOH的电离程度大于CH3COO-的水解程度,即有c(CH3COO-)>c(Na+),醋酸是弱酸,因此有c(Na+)>c(H+),因此离子浓度大小顺序是c(CH3COO-)> c(Na+)> c(H+)> c(OH-),故B说法正确;C、当pH=7时,溶质为CH3COONa和CH3COOH,因此消耗的NaOH的体积小于20.00mL,故C说法正确;D、当两者恰好完全反应时,溶质为CH3COONa,溶液显碱性,即此时消耗的NaOH的体积为20.00mL,故D说法错误。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】三草酸合铁(Ⅲ)酸钾是制备负载活性催化剂的主要原料。加热至110℃时失去结晶水,230℃时分解。极易感光,室温下光照变为黄色:
2K3[Fe(C2O4)3]·3H2O![]() 2FeC2O4·2H2O+3K2C2O4+2CO2↑+2H2O
2FeC2O4·2H2O+3K2C2O4+2CO2↑+2H2O
已知:
物质名称 | 化学式 | 相对分子质量 | 颜色 | 溶解性 |
三草酸合铁(Ⅲ)酸钾 | K3[Fe(C2O4)3]·3H2O | 491 | 翠绿色 | 可溶于水,难溶于乙醇 |
草酸亚铁 | FeC2O4·2H2O | 180 | 黄色 | 难溶于水,可溶于酸 |
某同学对三草酸合铁(Ⅲ)酸钾的制备及组成进行了实验探究。回答下列问题:
(一)三草酸合铁(Ⅲ)酸钾的制备
(ⅰ)称取4.50 g FeC2O4·2H2O固体,加入饱和K2C2O4溶液中,用滴管慢慢加入3% H2O2溶液,不断搅拌,并保持温度在40℃左右。充分反应后,沉淀转化为氧氧化铁。
(ⅱ)加热至沸腾,滴加1mol 的草酸溶液至沉淀溶解。用草酸或草酸钾调节溶液pH=4-5
(ⅲ)小火加热浓缩,冷却结晶,过滤,先用少量冰水洗涤,再用无水乙醇洗涤,低温干燥后称量,得到9.80g 翠绿色晶体。
(1)完成步骤(i)发生反应的离子方程式:
____FeC2O4·2H2O+______C2O42-+____H2O2=___Fe(OH)3+4[Fe(C2O4)3]3-+____H2O
(2)步骤(ⅲ)中,用无水乙醇洗涤晶体的目的是________。
(3)列式计算本实验中三草酸合铁(Ⅲ)酸钾的产率______________。
(二)草酸根含量侧定
准确称取4.80g 三草酸合铁(Ⅲ)酸钾样品,配制成250mL 溶液。量取25.00 mL 溶液置于锥形瓶中,加入5.0 mL 1mol/L H2SO4,用0.06mol/L的KMnO4 溶液滴定。滴定终点时消耗KMnO4溶液20.00mL。
(4)滴定过程中,盛放高锰酸钾溶液的仪器名称是_______________,滴定时发生反应的离子方程式为_____。
(5)样品中草酸根的物质的量为_______;若该数值大于4.80g二草酸合铁(Ⅲ)酸钾纯品中草酸根的物质的量,其原因可能是_______(填字母)。
a.制取过程中草酸或草酸钾用量过多
b.样品未完全干燥
c.滴定时盛放KMnO4溶液的仪器未用标准液润洗
d.锥形瓶洗净后未烘干
(三)某同学制得的三草酸合铁(Ⅲ)酸钾,晶体表面发黄,推测可能有部分晶体发生了分解。
(6)为了验证此推测是否正确,可选用的试剂是____________。