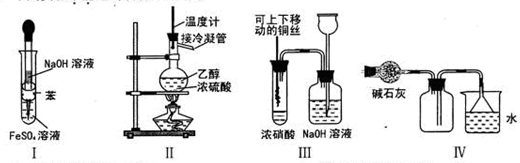
题目内容
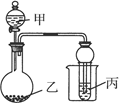
主要用于煤矿井下急救。某兴趣小组拟选用如下装置制备超氧化钾(部分夹持仪器已略去)。

请回答下列问题:
(1)请选择必要的装置,按气流方向的连接顺序为_____________(填仪器接口的字母)。
(2)请根据完整的实验装置,完成下列实验步骤:①_____________________;②装入药品,打开分液漏斗活塞;③持续通入气体一段时间后,点燃酒精灯进行反应;④反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;⑤拆除装置,取出产物。
(3)数据记录如下:

根据数据计算可得实验式KOx,则x=____________________。
(4)超氧化钾可吸收二氧化碳,并生成氧气,因此可以作为飞船、潜艇等密闭系统的氧气再生剂。写出超氧化钾与二氧化碳反应的化学方程式:__________________________。与过氧化钠相比,其优点是______________________________。

请回答下列问题:
(1)请选择必要的装置,按气流方向的连接顺序为_____________(填仪器接口的字母)。
(2)请根据完整的实验装置,完成下列实验步骤:①_____________________;②装入药品,打开分液漏斗活塞;③持续通入气体一段时间后,点燃酒精灯进行反应;④反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;⑤拆除装置,取出产物。
(3)数据记录如下:

根据数据计算可得实验式KOx,则x=____________________。
(4)超氧化钾可吸收二氧化碳,并生成氧气,因此可以作为飞船、潜艇等密闭系统的氧气再生剂。写出超氧化钾与二氧化碳反应的化学方程式:__________________________。与过氧化钠相比,其优点是______________________________。
(1)lefdejka(jk可互换) (2分)
(2)检测装置的气密性(2分)
(3)1.75(2分)
(4)4KO2+2CO2=2K2CO3+3O2(2分)相同质量的过氧化钠和超氧化钾相比,朝氧化钾释放的氧气多。(2分)
(2)检测装置的气密性(2分)
(3)1.75(2分)
(4)4KO2+2CO2=2K2CO3+3O2(2分)相同质量的过氧化钠和超氧化钾相比,朝氧化钾释放的氧气多。(2分)
试题分析:(1)根据超氧化钾(KO2),容易与空气中的水、二氧化碳等发生反应,因此制备的过程中一定要把装置所含的水和二氧化碳除去,进入到陶瓷管中的气体应先经过氢氧化钠溶液除二氧化碳,再经过浓硫酸干燥,陶瓷管后面也要接一个装有碱石灰的干燥管,防空气中的水和二氧化碳与超氧化钾接触,故顺序为:lefdejka(jk可互换);(2) 第一步应为检查装置的气密性;(3)钾的物质的量为:(15.19-14.80)/39=0.01mol,氧的物质的量=(15.47-5.19)/16=0.175mol,所以X=0.175mol/0.01mol=1.75;(4)过氧化钠与CO2反应的方程式为2Na2O2+2CO2=2NaCO3+O2,KO2与CO2反应的方程式为4KO2+2CO2=2K2CO3+3O2,故其优点是相同质量的过氧化钠和超氧化钾相比,朝氧化钾释放的氧气多。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目