��Ŀ����
����Ŀ����I�����÷�ӦCuSO4��Fe===Cu��FeSO4�����Ϊԭ��ء�
��1������������________(д����)���缫��ӦΪ__________________________________��
��2�������缫��ӦʽΪ______________________��
��3����Һ��SO42����________���ƶ���
(II)��ҵ�ϳɰ���Ӧ��N2��3H2![]() 2NH3��һ�����ȵĿ��淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�����
2NH3��һ�����ȵĿ��淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�����
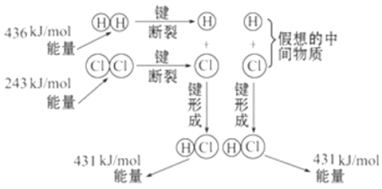
��4�������1 mol N2��3 mol H2��ϣ�ʹ���ַ�Ӧ���ų���������������ֵ����ԭ����____________________________��
��5��ʵ����ģ�ҵ�ϳɰ�ʱ�����ݻ�Ϊ2 L���ܱ������ڣ���Ӧ����10 min������10 mol NH3������N2��ʾ�Ļ�ѧ��Ӧ����Ϊ________mol��L��1��min��1��
��6��һ�������£����ϳɰ��ķ�Ӧ�ﵽ��ѧƽ��ʱ������˵����ȷ����________��
a������Ӧ���ʺ��淴Ӧ������� b������Ӧ��������淴Ӧ����Ϊ0
c����Ӧ�ﵽ����� d��N2��H2��Ũ�����
e������1 mol N2��ͬʱ������2 mol NH3 f������3 mol H2��ͬʱ������2 mol NH3
���𰸡��� Fe��2e��===Fe2�� Cu2����2e��===Cu �� �÷�Ӧ�ǿ��淴Ӧ��1 mol N2��3 mol H2������ȫ��Ӧ����˷ų�����������С��������ֵ 0.25 acf
��������
��I��(1)�÷�Ӧ�У���ʧ���ӷ���������Ӧ���������������ϵ缫��ӦʽΪ:Fe-2e-�TFe2+��
(2)���������õĽ�����ķǽ�������������ѡͭ������������ͭ���������Һ��������ͭ���ӵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ:Cu2++2e-�TCu��
(3) ��ԭ����У���Һ��������SO42�����ƶ���
(II)��4���÷�Ӧ�ǿ��淴Ӧ��1 mol N2��3 mol H2������ȫ��Ӧ����˷ų�����������С��������ֵ��
��5��v��NH3��=![]() =
=![]() =0.5mol/��Lmin����
=0.5mol/��Lmin����
v(N2) =![]() v(NH3)������v��N2��=0.25mol/��Lmin����
v(NH3)������v��N2��=0.25mol/��Lmin����
��6��a������Ӧ���ʺ��淴Ӧ������ȣ�˵����Ӧ�ﵽƽ��״̬����ȷ��
b������Ӧ��������淴Ӧ����Ϊ0����ָ��Ӧ��ʼʱ��״̬����Ӧû�дﵽƽ��״̬������
c��N2��ת���ʴﵽ���ֵ��˵����Ӧ�ﵽƽ��״̬����ȷ��
d��N2��H2��Ũ����ȣ���Ӧ��һ���ﵽƽ��״̬������
e��N2��H2��NH3�����������ȣ�����˵���䱣�ֲ��䣬���ж��Ƿ�ﵽƽ��״̬������
f����Ӧ�ﵽ����ȣ�˵����Ӧ�ﵽƽ��״̬����ȷ��
�ʴ�Ϊ��acf��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����֪2A(g)��B(g)![]() 2C(g)����H����a kJ��mol��1(a>0)����һ���д����Ĺ̶��ݻ��������м���2 mol A��1 mol B����500 ��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊ�� mol��L��1���ų�������Ϊb kJ��
2C(g)����H����a kJ��mol��1(a>0)����һ���д����Ĺ̶��ݻ��������м���2 mol A��1 mol B����500 ��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊ�� mol��L��1���ų�������Ϊb kJ��
��1����֪��A(g)��X(g)![]() 2B(g)����H����133.2 kJ��mol��1��
2B(g)����H����133.2 kJ��mol��1��
5A(g)��X(g)![]() 4C(g)����H����650.4 kJ��mol��1����a��________��
4C(g)����H����650.4 kJ��mol��1����a��________��
��2����ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�������ʾ���ɴ˿���֪������T1________T2(����>������������<��)��
T/K | T1 | T2 | T3 |
K | 6.86 | 2.45 | 1.88 |
��3����������������Ϊ��ѹ����(��Ӧǰ�����ͬ)����ʼʱ����2 mol A��1 mol B��500 ��ʱ��ַ�Ӧ��ƽ��ų�������Ϊd kJ����d________b(����>������������<��)��
��4����һ���¶��£���һ���ݻ��ɱ�ĺ�ѹ�����У�ͨ��3 mol A��2 mol B��������Ӧ2A(g)��B(g)![]() 2C(g)��ƽ��ʱ�������������ʵ���Ϊ��ʼʱ��80%������ͬһ��Ӧ�¶ȣ�����ͬ�����У�����ʼͶ������Ϊ6 mol A��4 mol B����ƽ��ʱA���������Ϊ________��
2C(g)��ƽ��ʱ�������������ʵ���Ϊ��ʼʱ��80%������ͬһ��Ӧ�¶ȣ�����ͬ�����У�����ʼͶ������Ϊ6 mol A��4 mol B����ƽ��ʱA���������Ϊ________��