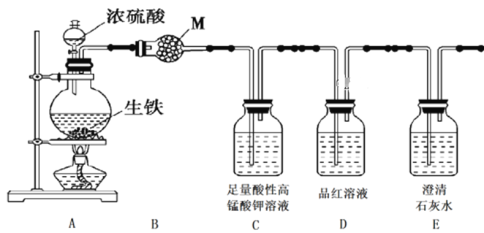
题目内容
【题目】恒温条件下将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内正反应的化学反应速率为___________;
(2)反应前A的物质的量浓度是___________;
(3)平衡时A的转化率为___________;
(4)能说明该反应达到平衡状态的是______________。
A.消耗3molA同时生成2molC B.反应体系中各物质的百分含量不变
C.混合气体平均相对分子质量不变 D.2V正(A)=3V逆(C)
【答案】0.04mol/(L·s) 1.5mol/L 40% BD
【解析】
(1)根据v=![]() 计算反应速率;
计算反应速率;
(2)根据速率比等于化学计量数的比计算出A物质的转化浓度,则A的起始浓度等于转化浓度与10s时浓度的和计算;
(3)可利用转化率=![]() ×100%计算;
×100%计算;
反应达到平衡时,正、逆反应速率相等,任何物质的物质的量、浓度、含量等不变。
(1)反应从正反应方向开始,到达平衡时生成C物质的物质的量是0.8mol,则用C表示10s 内正反应的化学反应速率为v(C)=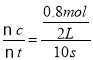 =0.04mol/(L·s);
=0.04mol/(L·s);
(2)根据方程式3A(g)+B(g)![]() 2C(g)+2D(g)可知:有3molA反应就会产生2molC,则反应产生了0.8molC,同时消耗了A的物质的量是1.2mol,由于此时还有A物质的量是1.8mol,则反应开始时A的物质的量是1.8mol+1.2mol=3.0mol,则反应开始时A的物质的量浓度c(A)=
2C(g)+2D(g)可知:有3molA反应就会产生2molC,则反应产生了0.8molC,同时消耗了A的物质的量是1.2mol,由于此时还有A物质的量是1.8mol,则反应开始时A的物质的量是1.8mol+1.2mol=3.0mol,则反应开始时A的物质的量浓度c(A)=![]() =1.5mol/L;
=1.5mol/L;
(3)开始时有A的物质的量是3.0mol,反应消耗A的物质的量是1.2mol,所以平衡时A的转化率为=![]() ×100%=
×100%=![]() ×100%=40%;
×100%=40%;
(4)A.反应速率之比等于化学计量数之比,无论是否平衡都存在消耗3mol A同时生成2mol C,因此不能据此说明达到平衡状态,A错误;
B.反应体系中各物质的百分含量不变,说明反应达到了平衡状态,B正确;
C.由于反应前后气体的质量、物质的量都不变,则混合气体平均相对分子质量不变,因此不能说明是否达到平衡状态,C错误;
D.2V正(A)=3V逆(C),说明正逆反应速率相等,达到了平衡状态,D正确;
故合理选项是BD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案