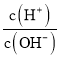题目内容
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,现在向0.001 mol·L-1K2CrO4和0.01 mol·L-1KCl混合液中滴加0.01 mol·L-1AgNO3溶液,通过计算回答:
(1)Cl-、CrO42-谁先沉淀________?
(2)刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是________?(设混合溶液在反应中体积不变)
【答案】Cl-先沉淀 4.13×10-6mol·L-1
【解析】
(1)由Ksp(AgCl)=c(Ag+)·c(Cl-)得Cl-开始沉淀所需c(Ag+)= =
=![]() mol·L-1=1.8×10-8mol·L-1,由Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42—)得CrO42-开始沉淀所需c(Ag+)=
mol·L-1=1.8×10-8mol·L-1,由Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42—)得CrO42-开始沉淀所需c(Ag+)=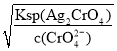 =
=![]() mol·L-1=4.36×10-5mol·L-1>1.8×10-8mol·L-1,生成AgCl沉淀需c(Ag+)小于生成Ag2CrO4沉淀时所需c(Ag+),故Cl-先沉淀
mol·L-1=4.36×10-5mol·L-1>1.8×10-8mol·L-1,生成AgCl沉淀需c(Ag+)小于生成Ag2CrO4沉淀时所需c(Ag+),故Cl-先沉淀
故答案为:Cl-先沉淀;
(2)刚开始生成Ag2CrO4沉淀时,c(Cl-)=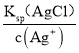 =
=![]() mol·L-1=4.13×10-6mol·L-1,
mol·L-1=4.13×10-6mol·L-1,
故答案为:4.13×10-6mol·L-1。

【题目】第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。继续失去第二个电子所需能量称第二电离能。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。回答下列问题:
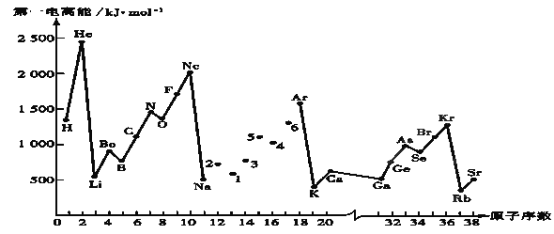
(1)同一周期元素的第一电离能从左到右总趋势是___(填增大、减小或不变,下同);同一主族元素原子从上到下的第一电离能I1变化规律是______________;稀有气体的第一电离能在同周期中是最大的,原因是______________________________________________________________________。
(2)认真分析上图中同周期元素第一电离能的变化规律,发现有一些反常,第一电离能 IIA>IIIA,VA>VIA: 如I1(铍)>I1(硼),2号大于1号,I1(氮)>I1(氧),5号大于4号。可能原因是____。(3)已知2号的I1=738KJ/mol, 则它的I2___738KJ/mol, I3___3×738KJ/mol;(填>、<、=)(4)已知5号和6号元素的电负性分别为2.1和3.0,则4号元素的电负性可能为(___)
A.3.5 | B.1.8 | C.2.5 | D.4.0 |
(5)上图中4、5、6三种元素最高价含氧酸的酸性从强到弱顺序为____________(用对应酸的化学式表示);它们的气态氢化物的稳定性均比同主族上一周期的元素气态氢化物弱,原因是:_________。
【题目】将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。
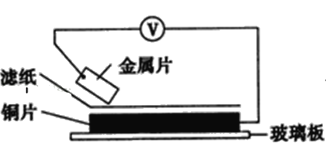
在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大)依据记录数据判断,下列结论中正确的是( )
金属 | 电子流动方向 | 电压(V) |
甲 | 甲→Cu | +0.78 |
乙 | Cu→乙 | -0.15 |
丙 | 丙→Cu | +1.35 |
丁 | 丁→Cu | +0.30 |
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中乙的还原性最强
D.甲、丁若形成原电池时,甲为正极