题目内容
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。
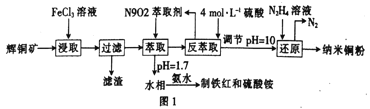
(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为____________________________。
(2)从辉铜矿中浸取铜元素时,可用FeCl 3溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl下标2+S,每生成1molCuCl2,反应中转移电子的物质的量为_____;浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为_________。
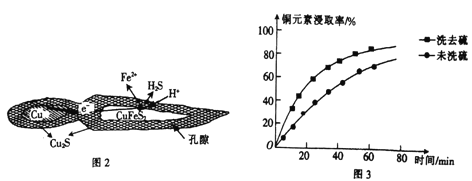
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3所示,未洗硫时铜元素浸取率较低,其原因是________________。
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是_________________。

(4)用“反萃取”得到的CuSO4 溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为_____。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____、干燥、____等操作可得到Fe2O3 产品。
【答案】 CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑ 2mol 4Fe2++O2+4H+=4Fe3++2H2O 生成的硫覆盖在Cu2S表面,阻碍浸取 Fe3+水解程度随pH的升高而增大 32:7 洗涤 煅烧(或灼烧)
【解析】(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,根据图示,同时生成了Fe2+和H2S,反应的离子方程式为CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑,故答案为:CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑;
(2)①根据反应: Cu2S+4FeCl3=2CuCl2+4FeCl2+S,反应中S元素由-2价升高为0价,Cu元素由+1价升高为+2价,铁元素由+3价降低为+2价,转移4个电子,则每生成1molCuCl2,反应中转移电子2mol;浸取时,在有氧环境下可维持Fe3+较高浓度,是因为氧气能够氧化亚铁离子,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,故答案为:2mol;4Fe2++O2+4H+=4Fe3++2H2O;
②浸取过程中加入洗涤剂溶解硫时,如果未洗硫,生成的硫覆盖在Cu2S表面,阻碍浸取,会使铜元素浸取率较低,故答案为:生成的硫覆盖在Cu2S表面,阻碍浸取;
(3)Fe3+的水解程度随着pH的升高而增大,萃取率越低;故答案为:Fe3+的水解程度随着pH的升高而增大;
(4)在碱性条件下,Cu2+与N2H4反应生成氮气和铜,反应为:2Cu2++N2H4+4OH-=2Cu+N2↑+4H2O,反应中铜元素化合价降低被还原,铜为还原产物,N元素化合价升高被氧化,氮气为氧化产物,还原产物与氧化产物的质量之比![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(5)萃取后的“水相”中含有铁离子,加入氨水,反应生成氢氧化铁沉淀,煅烧可得到,方法为:在萃取后的“水相”中加入适量氨水,静置,过滤,洗涤,干燥,煅烧可得到Fe2O3产品,故答案为:洗涤;煅烧。

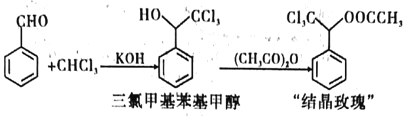
【题目】“结晶玫瑰”是具有强烈玫瑰香气的结晶型固体香料,在香料和日用化工产品中具有广阔的应用价值。其化学名称为“乙酸三氯甲基苯甲酯”,目前国内工业上主要使用以下路径来合成结晶玫瑰:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶政瑰”。
已知:
三氯甲基苯基甲醇 | 相对分子质量:225.5。无色液体。不溶于水,密度比水大,溶于乙醇 |
乙酸酐 | 无色液体。与水反应生成乙酸,溶于乙醇 |
“结晶玫瑰” | 相对分子质量:267.5。白色晶体。熔点:88℃。不溶于水,溶于乙醇 |
具体实验步骤如下:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
步骤一:装置如图所示。依次将苯甲醛、氯仿加入三颈烧瓶中,仪器A中加入KOH和助溶剂。滴加A中试剂并搅拌,开始反应并控制在一定温度下进行。

步骤二:反应结束后,将混合物依次用5%的盐酸、蒸馏水洗涤。
步骤三:将洗涤后的混合物蒸馏,除去其他有机杂质,加无水琉酸镁,过滤。滤液即为粗制三氯甲基萃基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶玫瑰”。
步骤四:向另一三颈瓶中加入制备的三氯甲基苯基甲醇、乙酸酐,并加入少量浓硫酸催化反应,加热控制反应温度在90℃~110℃之间。
步骤五:反应完毕后,将反应液倒入冰水中,冷却结晶获得“结晶玫瑰”。
请回答下列问题:
(1)仪器A的名称是_________。实验装置B中,冷凝水应从_____口进(填“a”或“b”)。
(2)步骤二中,用5%的盐酸洗涤的主要目的是___________。在洗涤、分液操作中,应充分振荡,然后静置,待分层后有机层应___________ (填序号)。
A.直接从上口倒出
B.先将水层从上口倒出,再将有机层从下口放出
C.直接从下口放出
D.先将水层从下口放出,再将有机层从下口放出
(3)步骤三中,加入无水硫酸镁的目的是___________。若未加入无水硫酸镁,直接将蒸馏所得物质进行后续反应,会使“结晶玫瑰”的产率偏______(填“高”或“低”),其原因是___________ (利用平衡移动原理解释)。(已知Ⅱ的具体反应如图所示)

(4)步骤四中,加料时,应先加入三氯甲基苯基甲醇和乙酸酐,然后慢慢加入浓硫酸并搅拌,主要是为了__________。加热反应时,为较好的控制温度,最适宜的加热方式为_____(填“水浴加热”或“油浴加热”)。
(5)22.55g三氟甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰21.40g,则产率是_____。

