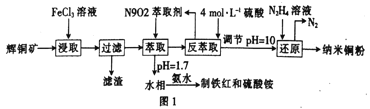
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ“Ϋ”Ο¬»Μ·ΗΤΩ…”Ο”Ύ…ζ≤ζ≤ΙΗΤΓΔΩΙΙΐΟτΚΆœϊ―ΉΒ»“©ΈοΓΘ“‘ΙΛ“ΒΧΦΥαΗΤΘ®Κ§”–…ΌΝΩMgCl2‘”÷ Θ©…ζ≤ζ“Ϋ“©ΦΕ¬»Μ·ΗΤΒΡ÷ς“ΣΝς≥Χ»γœ¬ΘΚ

«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©¬Υ‘ϋ÷–ΥυΚ§÷ς“ΣΈο÷ ΒΡΜ·―ß ΫΈΣ_____Θ§ ‘ΦΝA «_____ΓΘ
Θ®2Θ©…œ ωΝς≥Χ÷–Φ”»κΙΐΝΩΒΡ«β―θΜ·ΗΤ»ή“ΚΒΡΡΩΒΡ «_____Θ§ΥυΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_____ΓΘ
Θ®3Θ©…œ ωΝς≥Χ÷–Θ§Ϋχ––ΥαΜ·ΒΡΡΩΒΡ «_____Θ®”ΟΜ·―ßΖΫ≥Χ Ϋ±μ ΨΘ©ΓΘ
Θ®4Θ©≤ΌΉςIΒΡΟϊ≥Τ «_____Θ§≤ΌΉςΔρΒΡΟϊ≥Τ_____ΓΘ
ΓΨ¥πΑΗΓΩMg(OH)2―ΈΥα≥ΐ»Ξ»ή“Κ÷–ΒΡMg2+Ca(OH)2+MgCl2ΘΫMg(OH)2+CaCl2Ca(OH)2+2HClΘΫCaCl2+2H2OΙΐ¬Υ’τΖΔΫαΨß
ΓΨΫβΈωΓΩ
ΙΛ“ΒΧΦΥαΗΤΦ”»κΙΐΝΩΒΡ―ΈΥα»ήΫβ…ζ≥…¬»Μ·ΗΤΘ§»ή“Κ÷–Κ§”–…ΌΝΩMgCl2‘”÷ Θ§Φ”»κΙΐΝΩΒΡ«β―θΜ·ΗΤ≥ΝΒμΟΨάκΉ”Θ§Ιΐ¬ΥΒΟΒΫ¬Υ‘ϋΈΣ«β―θΜ·ΟΨ≥ΝΒμΘ§»ή“ΚΥαΜ·Φ”»κ―ΈΥα≥ΐ»ΞΙΐΝΩΒΡ«β―θΜ·ΗΤΘ§ΒΟΒΫ»ή“Κ’τΖΔΒΟΒΫ¬»Μ·ΗΤΙΧΧεΘ§Ψί¥ΥΫβ¥πΓΘ
Θ®1Θ©ΗυΨί“‘…œΖ÷ΈωΩ…÷ΣΘ§¬Υ‘ϋ÷–ΥυΚ§÷ς“ΣΈο÷ ΒΡΜ·―ß ΫΈΣMg(OH)2Θ§ ‘ΦΝA «―ΈΥαΘΜ
Θ®2Θ©”…”ΎΦ”»κ―ΈΥαΚσΒΟΒΫΒΡ»ή“Κ÷–Κ§”–¬»Μ·ΟΨ‘”÷ Θ§‘ρ…œ ωΝς≥Χ÷–Φ”»κΙΐΝΩΒΡ«β―θΜ·ΗΤ»ή“ΚΒΡΡΩΒΡ «≥ΐ»Ξ»ή“Κ÷–ΒΡMg2+Θ§ΥυΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣCa(OH)2+MgCl2ΘΫMg(OH)2+CaCl2ΘΜ
Θ®3Θ©”…”Ύ«β―θΜ·ΗΤΙΐΝΩΘ§‘ρ…œ ωΝς≥Χ÷–Θ§Φ”AΫχ––ΥαΜ·ΒΡΡΩΒΡ «≥ΐ»ΞΙΐΝΩΒΡCa(OH)2Θ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣCa(OH)2+2HClΘΫCaCl2+2H2OΘΜ
Θ®4Θ©ΗυΨί“‘…œΖ÷ΈωΩ…÷ΣΘ§≤ΌΉςΔώ «Ιΐ¬Υ≤ΌΉςΘ§≤ΌΉςΔρ «¥”»ή“Κ÷–ΒΟΒΫ¬»Μ·ΗΤΙΧΧεΘ§ΤδΟϊ≥Τ «’τΖΔΫαΨßΓΘ

 ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ
ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ –Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗ
–Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗΓΨΧβΡΩΓΩογœΒΈΣ‘ΣΥΊ÷ήΤΎ±μ÷–ΒΎΔσBΉεΓΔ‘≠Ή”–ρ ΐΈΣ57~71ΒΡ‘ΣΥΊΓΘ
Θ®1Θ©οα(Dy)ΒΡΜυΧ§‘≠Ή”ΒγΉ”≈≈≤Φ ΫΈΣ[Xe]4f106s2Θ§Μ≠≥ωοα(Dy)‘≠Ή”ΆβΈßΒγΉ”≈≈≤ΦΆΦΘΚ___________ΓΘ
Θ®2Θ©ΗΏΈ¬≥§ΒΦ≤ΡΝœογ±ΒΆ≠―θΜ·Έο÷–Κ§”–Cu3+Θ§ΜυΧ§ ±Cu3+ ΒΡΒγΉ”≈≈≤Φ ΫΈΣ________________ΓΘ
Θ®3Θ©Ιέ≤λœ¬ΟφΥΡ÷÷ογœΒ‘ΣΥΊΒΡΒγάκΡή ΐΨίΘ§≈–ΕœΉν”–Ω…Ρήœ‘ Ψ+3 ΦέΒΡ‘ΣΥΊ «___________(Χν‘ΣΥΊΟϊ≥Τ)ΓΘΦΗ÷÷ογœΒ‘ΣΥΊΒΡΒγάκΡή(ΒΞΈΜΘΚkJ mol-1)
‘ΣΥΊ | I1 | I2 | I3 | I4 |
Yb(ονΘ© | 604 | 1217 | 4494 | 5014 |
Lu(οεΘ© | 532 | 1390 | 4111 | 4987 |
La(ογΘ© | 538 | 1067 | 1850 | 5419 |
Ce(νφΘ© | 527 | 1047 | 1949 | 3547 |
Θ®4Θ©‘ΣΥΊνφ(Ce)Ω…“‘–Έ≥…≈δΚœΈο(NH4)2[Ce(NO3)6]ΓΘ
ΔΌΉι≥…≈δΚœΈοΒΡΥΡ÷÷‘ΣΥΊΘ§ΒγΗΚ–‘”…¥σΒΫ–ΓΒΡΥ≥–ρΈΣ________________(”Ο‘ΣΥΊΖϊΚ≈±μ Ψ)ΓΘ
ΔΎ–¥≥ωΒΣΒΡΉνΦρΒΞΤχΧ§«βΜ·ΈοΥ°»ή“Κ÷–¥φ‘ΎΒΡ«βΦϋΘΚ__________________(»Έ–¥“Μ÷÷)ΓΘ
Δέ‘ΣΥΊAl “≤”–άύΥΤ≥…Φϋ«ιΩωΘ§ΤχΧ§¬»Μ·¬ΝΖ÷Ή”±μ ΨΈΣ(AlCl3)2Θ§Ζ÷Ή”÷–Al ‘≠Ή”‘”Μ·ΖΫ ΫΈΣ_____________Θ§Ζ÷Ή”÷–ΥυΚ§Μ·―ßΦϋάύ–Ά”–______________(ΧνΉ÷ΡΗ)ΓΘ
a.άκΉ”Φϋ b.ΦΪ–‘Φϋ C.Ζ«ΦΪ–‘Φϋ d.≈δΈΜΦϋ
Θ®5Θ©PrO2(Εΰ―θΜ·οη)ΒΡΨßΧεΫαΙΙ”κCaF2œύΥΤΘ§ΨßΑϊ÷–οη‘≠Ή”ΈΜ”ΎΟφ–ΡΚΆΕΞΒψΘ§‘ρPrO2(Εΰ―θΜ·οη)ΒΡΨßΑϊ÷–”–________Ηω―θ‘≠Ή”ΘΜ“―÷ΣΨßΑϊ≤Έ ΐΈΣa pmΘ§ΟήΕ»ΈΣΠ― gΓΛ cm-3Θ§NA=_____________ (”ΟΚ§aΓΔΠ―ΒΡ¥ζ ΐ Ϋ±μ Ψ)ΓΘ
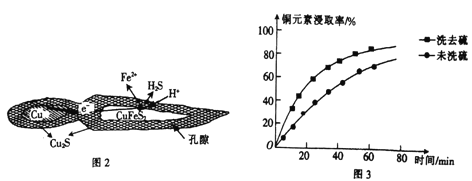
ΓΨΧβΡΩΓΩνβ «“Μ÷÷÷Ί“ΣΒΡΙΐΕ…Ϋπ τ‘ΣΥΊΘ§Ά®≥Θ”ΟΉςΚœΫπΦΑ≤Μ–βΗ÷ΒΡΧμΦ”ΦΝΘ§Ω…‘ω«ΩΚœΫπΒΡ«ΩΕ»ΓΔ”≤Ε»ΓΔΩ…ΚΗ–‘Β»ΓΘνβΥαΡΤΨßΧε(Na2MoO4ΓΛ2H2O)Ω…ΉςΈΣΈόΙΪΚΠ–Άά以հœΒΆ≥ΒΡΫπ τΗ· ¥“÷÷ΤΦΝΘ§»γΆΦ15 «Μ·ΙΛ…ζ≤ζ÷–“‘Μ‘νβΩσ(÷ς“Σ≥…Ζ÷ΈΣΝρΜ·νβMoS2)ΈΣ‘≠Νœά¥÷Τ±ΗΫπ τνβΓΔνβΥαΡΤΨßΧεΒΡ÷ς“ΣΝς≥ΧΆΦΓΘ

ΜΊ¥πœ¬Ν–Έ Χβ:
Θ®1Θ©“―÷ΣΖ¥”ΠΔέΈΣΗ¥Ζ÷ΫβΖ¥”ΠΘ§‘ρνβΥα÷–‘ΩΒΡΜ·ΚœΦέΈΣ___________ΓΘ
Θ®2Θ©Ζ¥”ΠΔόΒΡάκΉ”ΖΫ≥Χ ΫΈΣ___________ΓΘ
Θ®3Θ©Μ‘νβΩσΉΤ…’ ±ΒΡΜ·―ßΖΫ≥Χ ΫΈΣ____________ΓΘ
Θ®4Θ©≤ΌΉςXΈΣ_________ΓΘ“―÷ΣνβΥαΡΤ‘Ύ“ΜΕ®Έ¬Ε»ΖΕΈßΡΎΒΡΈω≥ωΈο÷ ΦΑœύ”ΠΈο÷ ΒΡ»ήΫβΕ»»γœ¬±μΥυ ΨΘ§‘ρ‘Ύ≤ΌΉςX÷–”ΠΩΊ÷ΤΈ¬Ε»ΒΡΉνΦ―ΖΕΈßΈΣ_______(Χν–ρΚ≈)ΓΘ
Έ¬Ε»(Γφ) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
Έω≥ωΈο÷ | Na2MoO4ΓΛ10H2O | Na2MoO4ΓΛ2H2O | Na2MoO4 | ||||||
»ήΫβΕ» | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0ΓφΓΪ10Γφ B.10ΓφΓΪ100Γφ C.15.5ΓφΓΪ50Γφ D.100Γφ“‘…œ
Θ®5Θ©÷Τ±ΗνβΥαΡΤΨßΧεΜΙΩ…”ΟΆ®ΙΐœρΨΪ÷ΤΒΡΜ‘νβΩσ÷–÷±Ϋ”Φ”»κ¥Έ¬»ΥαΡΤ»ή“Κ―θΜ·ΒΡΖΫΖ®Θ§»τ―θΜ·Ιΐ≥Χ÷–Θ§ΜΙ”–ΝρΥαΡΤ…ζ≥…Θ§‘ρ―θΜ·ΦΝ”κΜΙ‘≠ΦΝΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ_________ΓΘ
Θ®6Θ©LiΓΔMoS2Ω…≥δΒγΒγ≥ΊΒΡΙΛΉς‘≠άμΈΣxLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)nΗΫΉ≈‘ΎΒγΦΪ…œ]Θ§‘ρΒγ≥Ί≥δΒγ ±―τΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ___________________ΓΘ
Lix(MoS2)n[Lix(MoS2)nΗΫΉ≈‘ΎΒγΦΪ…œ]Θ§‘ρΒγ≥Ί≥δΒγ ±―τΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ___________________ΓΘ
Θ®7Θ©Ω…”ΟΜΙ‘≠–‘ΤχΧε(COΚΆH2)ΜΙ‘≠MoO3÷ΤνβΘ§ΙΛ“Β…œ÷Τ±ΗΜΙ‘≠–‘ΤχΧεCO![]() 2CO+2H2ΓΘΚ§ΦΉΆιΧεΜΐΖ÷ ΐΈΣ90%ΒΡ7L(±ξΉΦΉ¥Ωω)Χλ»ΜΤχ”κΉψΝΩΕΰ―θΜ·ΧΦ‘ΎΗΏΈ¬œ¬Ζ¥”ΠΘ§ΦΉΆιΉΣΜ·¬ ΈΣ80%,”Ο≤ζ…ζΒΡCOΚΆH2ΜΙ‘≠MoO3÷ΤνβΘ§άμ¬έ…œΡή…ζ≤ζνβΒΡ÷ ΝΩΈΣ_________ΓΘ
2CO+2H2ΓΘΚ§ΦΉΆιΧεΜΐΖ÷ ΐΈΣ90%ΒΡ7L(±ξΉΦΉ¥Ωω)Χλ»ΜΤχ”κΉψΝΩΕΰ―θΜ·ΧΦ‘ΎΗΏΈ¬œ¬Ζ¥”ΠΘ§ΦΉΆιΉΣΜ·¬ ΈΣ80%,”Ο≤ζ…ζΒΡCOΚΆH2ΜΙ‘≠MoO3÷ΤνβΘ§άμ¬έ…œΡή…ζ≤ζνβΒΡ÷ ΝΩΈΣ_________ΓΘ
ΓΨΧβΡΩΓΩœ¬Ν–”–ΙΊ Β―ιœ÷œσΜρ ¬ ΒΫβ Ά’ΐ»ΖΒΡ «(ΓΓΓΓ)ΓΘ
―Γœν | Β―ιœ÷œσΜρ ¬ Β | Ϋβ Ά |
A | Φλ―ι¥ΐ≤β“Κ÷–S | œ»ΒΈ»κ―ΈΥαΩ…≈≈≥ΐAg+ΓΔC |
B | ÷Τ±Η““Υα““θΞ ±,ΒΦΙή”Π…λ»κ ‘Ιή÷Ν±ΞΚΆNa2CO3»ή“ΚΒΡ“ΚΟφ…œΖΫ | ““Υα““θΞ“Ή»ή”ΎΧΦΥαΡΤ»ή“Κ,Ζά÷ΙΖΔ…ζΒΙΈϋ |
C | œρFe(NO3)2»ή“Κ÷–Φ”»κœΓΝρΥα, ‘ΙήΩΎ”–ΚλΉΊ…ΪΤχΧε≤ζ…ζ | »ή“Κ÷–N |
D | Κ§Mg(HCO3)2ΒΡ”≤Υ°≥Λ ±Φδ≥δΖ÷Φ”»»,Ήν÷’ΒΟΒΫΒΡ≥ΝΒμΈοΒΡ÷ς“Σ≥…Ζ÷ΈΣMg(OH)2,Εχ≤Μ «MgCO3 | Ksp(MgCO3)<Ksp[Mg(OH)2] |
A. A B. B C. C D. D