题目内容
【题目】(1)化学与生产生活密切相关,请写出下列反应
①实验室制氯气_________________(离子方程式)
②“腐蚀法”制作印刷电路板____________(化学方程式)并用双线桥表示该反应的电子转移数目和方向
(2)K2FeO4可用作水处理剂,它可由以下反应制得:
____Cl2 + ____ Fe(OH)3 + _____ OH- === ______ FeO4 2-+ _____ Cl- +____ H2O
配平此反应方程式。当1mol K2FeO4生成时,转移的电子数目为_____
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2 ↑+2H2O
Mn2++Cl2 ↑+2H2O  3 2 10 2 6 8 3NA 或1.806×1024
3 2 10 2 6 8 3NA 或1.806×1024
【解析】
(1)①实验室通过二氧化锰和浓盐酸反应制取氯气,方程式为MnO2+4H++2Cl-![]() Mn2++Cl2 ↑+2H2O;
Mn2++Cl2 ↑+2H2O;
②“腐蚀法”制作印刷电路板是用氯化铁刻蚀铜板,化学方程式为Cu+2FeCl3=CuCl2+2FeCl2,反应氯化铁是氧化剂在反应中得到电子,铜单质是还原剂在反应中失去电子,用双线桥表示该反应的电子转移数目和方向为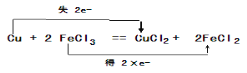 ;
;
(2)配平氧化还原反应,先通过得失电子数守恒对氧化还原部分进行配平,然后通过电荷守恒、原子守恒对剩余部分进行配平, 配平后的方程式为3Cl2 +2Fe(OH)3+10OH- =2FeO4 2-+6Cl-+8H2O,当1mol K2FeO4生成时,转移的电子数目为1.806×1024。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目