题目内容
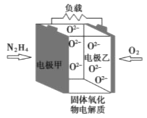
【题目】从废钒催化剂中回收钒,既能避免对环境的污染,又能节约宝贵的资源。回收工艺流程如下:
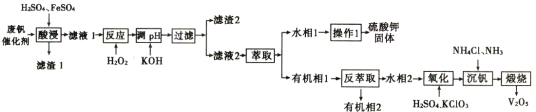
已知:①废钒催化剂中含有K2SO4、V2O5、V2O4、SiO2、Fe2O3、Al2O3等。
②“酸浸”时V2O5和V2O4先与稀H2SO4反应分别生成![]() 和VO2+。
和VO2+。
③有机萃取剂萃取VO2+的能力比萃取![]() 的能力强。
的能力强。
④溶液中![]() 与
与![]() 可相互转化:
可相互转化:![]() 。
。
(1)为了提高“酸浸”效率可采取得措施为______________________。
(2)“酸浸”时加入FeSO4目的是___________,FeSO4参与反应的化学方程式为__________。
(3)“滤渣2”的成分为______________;“操作1”的名称为_______________。
(4)在“氧化”步骤中氧化剂与还原剂的物质的质量之比为1:6,反应的离子方程式为_________________________________________。
(5)t℃时,“氧化”后溶液中c(![]() )=0.1mol/L,假设“沉钒”步骤中
)=0.1mol/L,假设“沉钒”步骤中![]() 全部转化
全部转化![]() ,并生成NH4VO3沉淀,为使沉钒效率达到95%.则此时溶液中c(
,并生成NH4VO3沉淀,为使沉钒效率达到95%.则此时溶液中c(![]() )≥______________。[已知t℃时Ksp(NH4VO3)=2.0×10-3,反应前后溶液的体积变化忽略不计]
)≥______________。[已知t℃时Ksp(NH4VO3)=2.0×10-3,反应前后溶液的体积变化忽略不计]
(6)取“煅烧”后的V2O5样品m g进行测定,加入足量稀硫酸充分反应后,配成250mL溶液。取该溶液25.00mL用bmol/L草酸溶液进行滴定,消耗草酸溶液cmL。则V2O5样品中钒的质量分数=_________%,样品的纯度≤___________%,样品的纯度小于该数值可能的原因是____________________________。(已知:①V2O5+2H+=2![]() +H2O ②2
+H2O ②2![]() +H2C2O4+2H+=2VO2+2CO2↑+2H2O)
+H2C2O4+2H+=2VO2+2CO2↑+2H2O)
【答案】升高酸浸温度和粉碎原料 使![]() 转化为VO2+ (VO2)2SO4+2FeSO4+2H2SO4=2VOSO4+Fe2(SO4)3+2H2O Fe(OH)3、Al(OH)3 蒸发结晶 3H2O+
转化为VO2+ (VO2)2SO4+2FeSO4+2H2SO4=2VOSO4+Fe2(SO4)3+2H2O Fe(OH)3、Al(OH)3 蒸发结晶 3H2O+![]() +6VO2+=6
+6VO2+=6![]() +Cl-+6H+ 0.4mol/L
+Cl-+6H+ 0.4mol/L ![]()
![]() 样品中含有NH4VO3
样品中含有NH4VO3
【解析】
从废钒催化剂中回收V2O5,由流程可知,“酸浸”时V2O5转化为VO2+,V2O4转成VO2+.氧化铁、氧化铝均转化为金属阳离子,只有SiO2不溶,则过滤得到的滤渣1为SiO2,然后加氧化剂H2O2,将VO2+变为VO2+,再加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,同时中和硫酸,过滤得到的滤渣2为Fe(OH)3、Al(OH)3,萃取后水相1流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5。
(1) 酸浸”时V2O5转化为VO2+,为了提高“酸浸”效率可采取得措施为升高酸浸温度和粉碎原料。
(2)亚铁离子具有还原性,“酸浸”时加入FeSO4目的是使![]() 转化为VO2+,FeSO4参与反应的化学方程式为(VO2)2SO4+2FeSO4+2H2SO4=2VOSO4+Fe2(SO4)3+2H2O。
转化为VO2+,FeSO4参与反应的化学方程式为(VO2)2SO4+2FeSO4+2H2SO4=2VOSO4+Fe2(SO4)3+2H2O。
(3) 根据图示,加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,同时中和硫酸,“滤渣2”的成分为Fe(OH)3、Al(OH)3;硫酸钾受热稳定,“操作1”的名称为蒸发结晶。
(4)在“氧化”步骤中氧化剂与还原剂的物质的质量之比为1:6,根据氧化还原反应原理,氧化剂为氯化钾,还原剂为VO2+,反应的离子方程式为3H2O+![]() +6VO2+=6
+6VO2+=6![]() +Cl-+6H+。
+Cl-+6H+。
(5)t℃时,“氧化”后溶液中c(![]() )=0.1mol/L,假设“沉钒”步骤中
)=0.1mol/L,假设“沉钒”步骤中![]() 全部转化
全部转化![]() ,化合价不变,c(
,化合价不变,c(![]() )=0.1mol/L,为使沉钒效率达到95%,则溶液中此时
)=0.1mol/L,为使沉钒效率达到95%,则溶液中此时![]() )≤0.005mol/L ,即c(
)≤0.005mol/L ,即c(![]() )≥
)≥![]() 0.4mol/L。
0.4mol/L。
(6)取“煅烧”后的V2O5样品m g进行测定,加入足量稀硫酸充分反应后,V2O5+2H+=2![]() +H2O,配成250mL溶液,取该溶液25.00mL用bmol/L草酸溶液进行滴定,消耗草酸溶液cmL,滴定过程中涉及的反应方程为2
+H2O,配成250mL溶液,取该溶液25.00mL用bmol/L草酸溶液进行滴定,消耗草酸溶液cmL,滴定过程中涉及的反应方程为2![]() +H2C2O4+2H+=2VO2+2CO2↑+2H2O,则滴定过程消耗的c(VO2+)=2bc×10-3mol,即五氧化二钒的物质的量为bc×10-3mol ,V2O5样品中钒的质量分数=
+H2C2O4+2H+=2VO2+2CO2↑+2H2O,则滴定过程消耗的c(VO2+)=2bc×10-3mol,即五氧化二钒的物质的量为bc×10-3mol ,V2O5样品中钒的质量分数=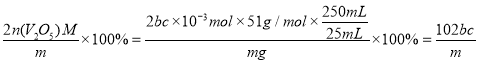 %,样品的纯度≤
%,样品的纯度≤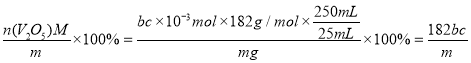 %,样品的纯度小于该数值可能的原因是样品中含有NH4VO3。
%,样品的纯度小于该数值可能的原因是样品中含有NH4VO3。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案