题目内容
10. 防治环境污染,改善生态环境已成为全球共识.
防治环境污染,改善生态环境已成为全球共识.①2015年辽宁供暖季开始一周后,全省多地迎来持续的六级严重污染天气.沈阳PM2.5浓度爆表,一度超过1000微克/立方米.燃煤气化有助于减少PM2.5,写出焦炭与水蒸气反应的化学方程式C+H2O$\frac{\underline{\;高温\;}}{\;}$ CO+H2;
②“8•12”天津港特大爆炸核心区700吨氰化钠的处理曾牵动各方神经.方案之一是用强氧化性物质将其氧化.下列可用于处于处理的是b(填字母);
a.盐酸 b.双氧水 c.熟石灰
③下列是生活中的常见垃圾:A.废纸 B.易拉罐 C.废电池 D.玻璃瓶 E.塑料制品,在焚烧发电处理前,除废电池外,还有BD(填字母)应剔除并回收,易拉罐等铝制容器不能长时间与酸、碱接触,写出铝与氢氧化钠溶液反应的方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑,如右图是贴在某垃圾桶上的标志,该标志的含义是可回收.
分析 ①焦炭与水蒸气反应生成一氧化碳和氢气;
②根据有强氧化性的物质解题;
③不能燃烧的垃圾,不能采用焚烧处理;铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,图为可回收标志.
解答 解:①焦炭与水蒸气反应生成一氧化碳和氢气,其反应的方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$ CO+H2,故答案为:C+H2O$\frac{\underline{\;高温\;}}{\;}$ CO+H2;
②双氧水有强氧化性,盐酸和熟石灰无强氧化性,故答案为:b;
③易拉罐、玻璃瓶不能燃烧,所以不能采用焚烧处理,电池中的重金属能污染环境,所以不能随意丢弃电池;铝与氢氧化钠溶液反应生成偏铝酸钠和氢气:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,图为可回收标志,故答案为:BD;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;可回收.
点评 本题考查知识点较多,注重化学与生活的联系,熟悉常见的环境污染物,并关注环境保护,利用化学知识来解决生活中的问题即可解答,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
20.今有如下三个热化学方程式:
H2(g)+$\frac{1}{2}$ O2 (g)═H2O (g)△H=a kJ•mol-1
H2 (g)+$\frac{1}{2}$ O2 (g)═H2O (l)△H=b kJ•mol-1
2H2 (g)+O2 (g)═2H2O (g)△H=c kJ•mol-1
关于它们的下列表述正确的是( )
H2(g)+$\frac{1}{2}$ O2 (g)═H2O (g)△H=a kJ•mol-1
H2 (g)+$\frac{1}{2}$ O2 (g)═H2O (l)△H=b kJ•mol-1
2H2 (g)+O2 (g)═2H2O (g)△H=c kJ•mol-1
关于它们的下列表述正确的是( )
| A. | 它们都是吸热反应 | B. | a、b和c均为正值 | ||
| C. | a=b | D. | 2a=c |
1.将pH=4的酸性溶液与pH=10的NaOH溶液等体积混合后,溶液的pH可能是( )
| A. | 等于7 | B. | 大于7 | C. | 小于7 | D. | 无法确定 |
19.碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用.
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是SiO2+2NaOH═Na2SiO3+H2O(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是D.
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
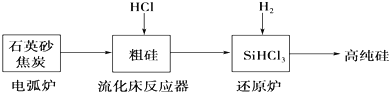
①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
③SiHCl3极易水解,其完全水解的化学方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是SiO2+2NaOH═Na2SiO3+H2O(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是D.
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |

 现有反应:CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,如图表示反应Ⅱ在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,则图中t2时刻发生改变的条件可能是B.
现有反应:CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,如图表示反应Ⅱ在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,则图中t2时刻发生改变的条件可能是B.