题目内容
5.焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂.焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化.实验室制备焦亚硫酸钠过程中依次包含以下几步反应:2NaOH+SO2=Na2SO3+H2O …(a)
Na2SO3+H2O+SO2=2NaHSO3…(b)
2NaHSO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2S2O5+H2O …(c)
实验装置如下:

(1)实验室可用废铝丝与NaOH溶液反应制取H2,制取H2的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)图1装置中,导管X的作用是排出H2、未反应的SO2及水蒸气等.
(3)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄.“温度迅速升高”的原因为SO2与NaOH溶液的反应是放热反应;
实验后期须保持温度在约80℃,可采用的加热方式为80℃水浴加热.
(4)反应后的体系中有少量白色亚硫酸钠析出,参照图2溶解度曲线,除去其中亚硫酸钠固体的方法是趁热过滤;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是此时溶液中Na2SO3不饱和,不析出.
(5)用图3装置干燥Na2S2O5晶体时,通入H2的目的是排出空气,防止焦亚硫酸钠被氧化;真空干燥的优点是干燥室内部的压力低,水分在低温下就能气化,减少产品氧化.
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法.已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2=S4O62-+2I-
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水).
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中.
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水.
③用标准Na2S2O3溶液滴定至接近终点. ④加入1~2mL淀粉溶液. ⑤继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积.
⑥重复步骤①~⑤;根据相关记录数据计算出平均值.
分析 (1)铝和NaOH溶液反应生成偏铝酸钠和氢气;
(2)该装置中二氧化硫和氢氧化钠发生反应,通入氢气能防止亚硫酸盐被氧化,如果锥形瓶内压强过大会产生安全事故;
(3)SO2与NaOH溶液的反应是放热反应导致溶液温度升高;温度小于100℃时要采用水浴加热;
(4)根据图知,温度越高Na2S2O5溶解度增大,当接近40℃时亚硫酸钠溶解度减小;控制“30℃左右”时,此时溶液中Na2SO3不饱和;
(5)焦亚硫酸钠能被压强氧化;真空干燥时,干燥室内部的压力低,水分在低温下就能气化;
(6)④碘能使淀粉变蓝色,所以可以用淀粉试液检验滴定终点;
⑤继续做实验为:继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积.
解答 解:(1)铝和NaOH溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)该装置中二氧化硫和氢氧化钠发生反应,通入氢气能防止亚硫酸盐被氧化,如果锥形瓶内压强过大会产生安全事故,所以导管的作用是排出H2、未反应的SO2及水蒸气等,从而防止安全事故的发生,
故答案为:排出H2、未反应的SO2及水蒸气等;
(3)SO2与NaOH溶液的反应是放热反应导致溶液温度升高,所以溶液“温度迅速升高”;温度小于100℃时要采用水浴加热,需要的温度是80℃,所以用水浴加热;
故答案为:SO2与NaOH溶液的反应是放热反应;80℃水浴加热;
(4)根据图知,温度越高Na2S2O5溶解度增大,当接近40℃时亚硫酸钠溶解度减小,所以要趁热过滤;控制“30℃左右”时,此时溶液中Na2SO3不饱和,不析出,
故答案为:趁热过滤;此时溶液中Na2SO3不饱和,不析出;
(5)焦亚硫酸钠能被压强氧化,则通入氢气的目的是排出空气,防止焦亚硫酸钠被氧化;真空干燥时,干燥室内部的压力低,水分在低温下就能气化,从而减少产品氧化,
故答案为:排出空气,防止焦亚硫酸钠被氧化;干燥室内部的压力低,水分在低温下就能气化,减少产品氧化;
(6)④碘能使淀粉变蓝色,所以可以用淀粉试液检验滴定终点,需要的操作是加入1~2mL淀粉溶液,故答案为:加入1~2mL淀粉溶液;
⑤继续做实验为:继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积,然后再重复实验,减少实验误差,
故答案为:继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积.
点评 本题考查制备实验方案设计,为高频考点,明确实验原理及物质性质是解本题关键,侧重考查学生实验操作、实验评价、物质制备能力,知道各个仪器的作用,题目难度中等.

| A. | 淀粉和纤维素的分子式都是(C6H10O5)n,所以它们都是同分异构体. | |
| B. | 糖类都是有甜味的物质 | |
| C. | 鉴别织物成分是真丝还是人造丝可以用灼烧的方法. | |
| D. | 蔗糖水解前后都可以发生银镜反应 |
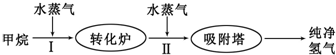
(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇.
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ•mol-1和726.5kJ•mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ•mol-1.
(2)此流程的第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1<P2.(填“<”、“>”或“=”)100℃时,将1mol CH4和2mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=0.0225(或2.25×10-2).
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)?CO2(g)+H2(g),的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图3,电极为多孔惰性材料.则负极的电极反应式是2H2O+NO-3e-=NO3-+4H+.
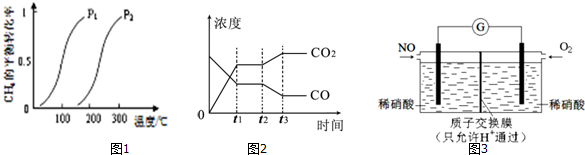
湿法制备:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O
干法制备:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法中错误的是( )
| A. | 高铁酸钾处理水时,水发生氧化反应 | |
| B. | 湿法中每生成1mol Na2FeO4共转移3mol电子 | |
| C. | 干法中每生成1mol Na2FeO4共转移3mol电子 | |
| D. | K2FeO4处理水时,不仅能杀菌,并能使悬浮杂质沉降 |
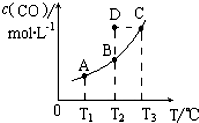 在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )| A. | 该反应的△H>0 | |
| B. | 若T1、T2 时的平衡常数分别为K1、K2,则K1=K2 | |
| C. | 通过加热可以使B 点变到C 点 | |
| D. | 在T2时若反应进行到状态D,则一定有υ(正)<υ(逆) |
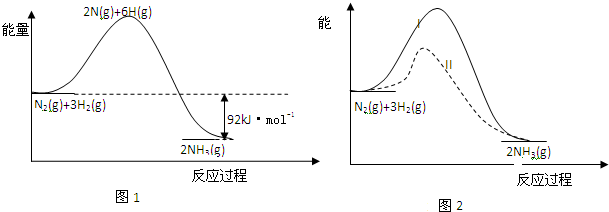
 防治环境污染,改善生态环境已成为全球共识.
防治环境污染,改善生态环境已成为全球共识.