题目内容
【题目】电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。下图是某同学用0.1mol/L KOH 溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH 溶液滴定曲线示意图(混合溶液体积变化忽略不计)。下列有关判断不正确的是
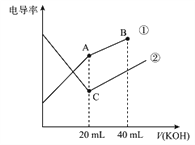
A. 曲线①代表0.1mol/L KOH 溶液滴定CH3COOH溶液的滴定曲线,曲线②代0.1mol/LKOH 溶液滴定HCl溶液的滴定曲线
B. 在相同温度下,C点水电离的c (H+) 大于A点水电离的c(H+)
C. 在A 点的溶液中有: c(CH3COO-)+c(OH-)-c (H+)=0.05mol/L
D. 在B 点的溶液中有: c(K+)>c(OH-)>c(CH3COO-)>c(H+)
【答案】B
【解析】A、相同浓度的CH3COOH溶液和HCl溶液,由于醋酸是弱酸,所以醋酸溶液的导电能力弱于盐酸,图象中起始时曲线①的导电能力弱于曲线②,故A正确;B、图象中A、C两点分别表示KOH与CH3COOH、KOH与HCl恰好完全反应,由于CH3COOK水解使溶液呈碱性,促进了水的电离,而KCl不水解,溶液呈中性,所以C点水电离的c(H+)小于A点水电离的c(H+),故B错误;C、A点为KOH与CH3COOH恰好完全反应生成的CH3COOK溶液,其浓度为c(CH3COOK)= 0.05mol/L= c(K+),由电荷守恒可得:c(CH3COO-)+c(OH-)=c(H+)+ c(K+),所以c(CH3COO-)+c(OH-)-c(H+)= c(K+)=0.05mol/L,故C正确;D、B点为物质的量浓度均为0.1/3mol/L的CH3COOK和KOH的混合溶液,因CH3COO-水解,所以有c(K+)>c(OH-)>c(CH3COO-)>c(H+),故D正确。本题正确答案为B。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
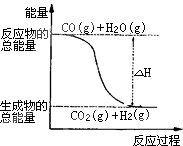
初中学业考试导与练系列答案【题目】在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)2NH3(g)△H2=﹣92.4kJ/mol,有关数据及特定平衡状态见表.
容器 | 起始投入 | 达平衡时 | |||
甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
乙 | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
(1)若平衡后同种物质的体积分数相同,起始时乙容器通入的N2的物质的量为 ,
起始时乙中的压强是甲容器的倍,乙的平衡常数为
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是(选填序号).
选项 | a | b | c | d |
x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
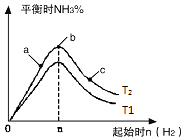
(3)研究在其他条件不变时,改变起始物氢气的物质的量对反应的影响,实验结果如图所示(图中T表示温度,n表示物质的量):
①像中T2和T1的关系是:T2T1(填“高于”“低于”“等于”“无法确定”).
②a、b、c三点中,N2转化率最高的是(填字母).
③若容器容积为1L,T2℃在起始体系中加入1mol N2 , 3molH2 , 经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为 . 保持容器体积不变,若起始时向容器内放入2mol N2和6mol H2 , 达平衡后放出的热量为Q,则Q110.88kJ(填“>”、“<”或“=”).