题目内容
16.已知元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )| A. | 离子还原性Y2->Z-.质子数c>b | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 原子半径X<W,第一电离能X<W | D. | 电负性Z>Y>W>Z |
分析 元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,结合元素周期律解答.
解答 解:元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,
A.非金属性F>O,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性Y2->Z-,由以上分析可知c=8,b=11,质子数b>c,故A错误;
B.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为HZ>H2Y,故B错误;
C.W为Al元素,X为Na元素,原子半径Na>Al,第一电离能:Na<Al,故C错误;
D.元素的非金属性越强,电负性越强,则电负性Z>Y>W>Z,故D正确.
故选D.
点评 本题考查结构与位置关系、元素周期律等,难度中等,根据电荷与核外电子排布相同推断元素在周期表中的位置是关键.

练习册系列答案
相关题目
6.在相同的条件下,用下列两种方法制取氯气,①用含HCl 2mol的浓盐酸和足量的二氧化锰反应,②用43.5g 的MnO2和足量的浓盐酸反应,则所得Cl2 的物质的量( )
| A. | ①和②一样多 | B. | ②比①多 | C. | ①比②多 | D. | 无法比较 |
7.下列反应不属于氧化还原反应的是( )
| A. | 由氧化铝冶炼铝 | B. | 天然气的燃烧 | ||
| C. | 钢铁的腐蚀 | D. | 生石灰转化为熟石灰 |
1.下列说法正确的是( )
| A. | 溴水不可用于鉴别苯、四氯化碳、乙醇三种无色液体 | |
| B. | 欲从溴水中分离出Br2,可将适量CCl4加入溴水中振荡静置分层后分液 | |
| C. | 配制一定物质的量浓度的硫酸溶液时,只需使用1次玻璃棒 | |
| D. | 氢气还原氧化铜实验先加热后通氢气 |
5.在一个容积固定为2L的密闭容器中,发生反应aA(g)+bB(g)?pC(g)△H=?反应情况记录如表:
请仔细分析表中数据,回答下列问题:
(1)p=2,a=1,b=2(取最小整数)
(2)第2min到第4min内,A的平均反应速率v(A)=0.2 mol•L-1•min-1
(3)若从开始到第4min建立平衡时,反应放出的热量为234kJ,则该反应的△H=-195.
| 时间 | c(A)/(mol•L-1) | c(B)/(mol•L-1) | c(C)/(mol•L-1) |
| 0min | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.4 |
| 第4min | 0.4 | 1.8 | 1.2 |
| 第6min | 0.4 | 1.8 | 1.2 |
(1)p=2,a=1,b=2(取最小整数)
(2)第2min到第4min内,A的平均反应速率v(A)=0.2 mol•L-1•min-1
(3)若从开始到第4min建立平衡时,反应放出的热量为234kJ,则该反应的△H=-195.
6.一定温度下,在定容容器中发生反应:X(g)+2Y(g)?4Z(g).下列叙述中能说明该反应已达到平衡状态的是( )
| A. | 单位时间内消耗amolX,同时生产4amolZ | |
| B. | 容器内的氧气不再变化 | |
| C. | Z的生成速率与Y的生成速率比值为1:2 | |
| D. | 容器内气体的密度不发生变化 |
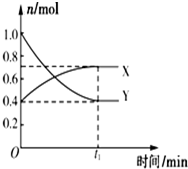 某温度下,在2L密闭容器中,发生NO2和N2O4之间的反应:N2O4(g)?2NO2(g),各物质的量随时间的变化关系如图所示,请回答下列问题.
某温度下,在2L密闭容器中,发生NO2和N2O4之间的反应:N2O4(g)?2NO2(g),各物质的量随时间的变化关系如图所示,请回答下列问题.