题目内容
8.某化学兴趣小组的同学欲除去固体氯化钠中混有的氯化钙,请根据如下实验方案回答问题.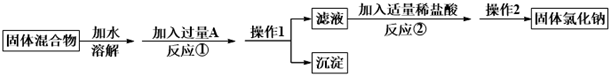
(1)A物质的化学式为Na2CO3;操作1的名称是过滤.
(2)反应①中加入略过量的A物质的目的是保证钙离子沉淀完全;判断A已过量的实验操作方法是静置后取少量上层清液,滴加适量的稀盐酸,若有气体生成,则说明碳酸钠已过量.
(3)写出反应②的化学方程式:Na2CO3+2HCl=2NaCl+CO2↑+H2O.如果加入盐酸过量,则对所得到的氯化钠的纯度没有(填“有”或“没有”)影响.
(4)实验时称取样品的质量为185.0g,经过操作1后,测得沉淀(不溶于水)的质量为50.0g,则样品中NaCl的质量分数是70%.
分析 由分离流程可知,溶解后加过量的Na2CO3可除去氯化钙,操作①为过滤,得到沉淀为碳酸钙,滤液中含NaCl、Na2CO3,加适量盐酸,与碳酸钠反应,操作②为蒸发,最后得到NaCl,以此来解答.
解答 解:由分离流程可知,溶解后加过量的Na2CO3可除去氯化钙,操作①为过滤,得到沉淀为碳酸钙,滤液中含NaCl、Na2CO3,加适量盐酸,与碳酸钠反应,操作②为蒸发,最后得到NaCl,
(1)由上述分析可知,A为Na2CO3,操作1的名称是过滤,故答案为:Na2CO3;过滤;
(2)反应①中加入略过量的A物质的目的是保证钙离子沉淀完全;判断A已过量的实验操作方法是静置后取少量上层清液,滴加适量的稀盐酸,若有气体生成,则说明碳酸钠已过量(或取上层清液少许继续滴加碳酸钠溶液无浑浊),
故答案为:保证钙离子沉淀完全;静置后取少量上层清液,滴加适量的稀盐酸,若有气体生成,则说明碳酸钠已过量;
(3)反应②的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O.因盐酸易挥发,如果加入盐酸过量,则对所得到的氯化钠的纯度没有影响,
故答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
(4)经过操作1后,测得沉淀(不溶于水)的质量为50.0g,则n(CaCl2)=n(CaCO3)=$\frac{50.0g}{100g/mol}$=0.5mol,则样品中NaCl的质量分数是$\frac{185.0g-0.5mol×111g/mol}{185.0g}$×100%=70%,故答案为:70%.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、流程中的反应混合物分离提纯方法的选择为解答的关键,侧重分析与实验、计算能力的综合考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列离子反应方程式正确的是( )
| A. | 硫酸与氢氧化钡反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 醋酸滴在锌片上:Zn+2H+═Zn2++H2↑ | |
| D. | Na2C03溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ |
16.已知元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 离子还原性Y2->Z-.质子数c>b | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 原子半径X<W,第一电离能X<W | D. | 电负性Z>Y>W>Z |
20.在一个体积固定的密闭容器中加入2mol A和1mol B,发生反应:2A(g)+B(g)?3C(g)+D(g),达到平衡时C的浓度为a mol/L.若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol/L的是( )
| A. | 4 mol A+2 mol B | B. | 2 mol A+1 mol B+1 mol He | ||
| C. | 3 mol C+2 mol D | D. | 2 mol A+1 mol D |
17.下列有关化学反应原理的应用叙述中,正确的是( )
| A. | 电解饱和食盐水制烧碱,NaOH在阳极区域产生 | |
| B. | 合成氨生成过程中,采用高温高压都是为了提高N2、H2的转化率 | |
| C. | 给铁钉镀铜时,用铜做阴极 | |
| D. | 用明矾净水是因为Al3+水解生成的Al(OH)3胶粒具有很强的吸附性 |
18.下列说法正确的是( )
| A. | 分子中一定存在共价键 | |
| B. | 有原子构成的晶体一定是原子晶体 | |
| C. | 含有阴离子的化合物一定含有阳离子 | |
| D. | 非金属元素组成的化合物一定是共价化合物 |
 (注明反应条件).
(注明反应条件).