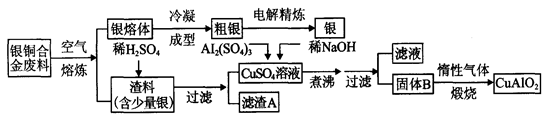
题目内容
一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物

填空和回答下列问题:
(1)B物质是 (写化学式)
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一步设计有毛病,这一步的正确设计方案应是 。
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是 。
(4)请写出从B到C的离子方程式 。

填空和回答下列问题:
(1)B物质是 (写化学式)
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一步设计有毛病,这一步的正确设计方案应是 。
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是 。
(4)请写出从B到C的离子方程式 。
(1)CaCO3; (2)加入适量盐酸至不产生气体
(3)A ; CaCO3+2H+=Ca2++CO2↑+H2O
(3)A ; CaCO3+2H+=Ca2++CO2↑+H2O
试题分析:(1)NaCl和CaCl2两种固体混合物,溶解后加入过量碳酸钠溶液,生成碳酸钙沉淀和氯化钠,过滤后得到的沉淀B为碳酸钙;(2)由于碳酸钠过量,所以滤液中的物质有氯化钠和碳酸钠,因此要得到纯净的氯化钠就需要除去碳酸钠,向滤液中加入适量盐酸至不产生气体,生成氯化钠和水和二氧化碳,蒸发后最后的固体物质是氯化钠;(3)要测定该样品中NaCl和CaCl2的质量比,可称量干燥的碳酸钙的质量,根据反应CaCO3+2H+=Ca2++CO2↑+H2O可计算氯化钙的质量,混合物A的总质量减去氯化钙的质量可得氯化钠的质量;(4)碳酸钙和盐酸发生:CaCO3+2H+=Ca2++CO2↑+H2O,得到氯化钙溶液,经蒸发可得到氯化钙固体。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

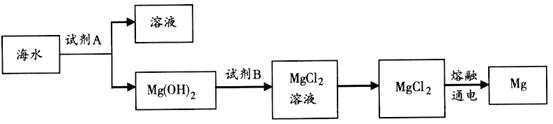
 转化为MgCl2的离子方程式是________________________________。
转化为MgCl2的离子方程式是________________________________。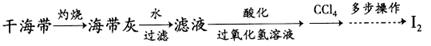
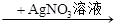 生成白色沉淀,说明原溶液中有Cl-
生成白色沉淀,说明原溶液中有Cl-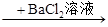 生成白色沉淀,说明原溶液中有SO42-
生成白色沉淀,说明原溶液中有SO42-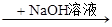 生成红褐色沉淀,说明原溶液中有Fe3+
生成红褐色沉淀,说明原溶液中有Fe3+ 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-