��Ŀ����
����Ŀ��ˮ�е��ܽ�����ˮ���������治��ȱ�ٵ�������ij����С����õ������ⶨѧУ�ܱߺ�ˮ�е��ܽ�����ʵ�鲽�輰�ⶨԭ�����£�
��ȡ�������Ĺ̶�
���ܽ���ƿ�ɼ�ˮ������¼����ѹ��ˮ���¶ȣ���ˮ����Mn��OH��2��������Һ������KI����ϣ���Ӧ����MnO��OH��2 �� ʵ�����Ĺ̶���
���ữ���ζ�
�ڵ���ƿ�н��������ˮ���ữ��MnO��OH��2��I����ԭΪMn2+���÷�Ӧ���ȣ����ڰ�������5min��Ȼ���ñ�Na2S2O3��Һ�ζ����ɵ�I2��2S2O ![]() +I2�T2I��+S4O
+I2�T2I��+S4O ![]() ��
��
�ش��������⣺
��1�������Ĺ̶����з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2��ˮ���ữ������Ӧ�����ӷ���ʽ ��
��3���ڵ���ƿ����ͼ���н��з�Ӧ��Ҫ�����������������ϵ�����ˮ����������Ŀ���� �� 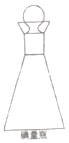
��4��Na2S2O3��Һ���ȶ����ױ������������ܵ�ˮ��CO2�Լ������Ӱ����ֽ⣬���Ƹ���Һʱ��Ҫ������ˮ���뾭����С���ȴ�����ʹ�ã���Ŀ���� ��
��5��Na2S2O3��Һ���ȶ���ʹ��ǰ��궨��KIO3������궨Na2S2O3��Һ��Ũ�ȣ���ȡ0.214g KIO3�������KI���ã������ĵ���Na2S2O3��Һ�ζ�����ȥ24.00mL����Na2S2O3��Һ��Ũ��Ϊ����֪M��KIO3��=214.0gmol��1��
��6��ȡ100.00mL ˮ�����������ữ���ø� Na2S2O3��Һ�ζ����Ե�����Һ��ָʾ�����յ�����Ϊ��������Na2S2O3��Һ�����Ϊ10mL����ˮ�����ܽ����ĺ���ΪmgL��1 ��
���𰸡�
��1��2Mn��OH��2+O2=2MnO��OH��2
��2��MnO��OH��2+2I��+4H+=I2+Mn2++3H2O
��3��Һ�⡢��ֹ��ӷ�
��4��ɱ������������������̼
��5��0.25mol/L
��6�������һ�α�Һ����ʱ,��Һ����ɫ��Ϊ��ɫ,�Ұ�������ޱ仯,200
���������⣺��1�������Ĺ̶����з�����Ӧ�Ļ�ѧ����ʽΪ��2Mn��OH��2+O2=2MnO��OH��2��
���Դ��ǣ�2Mn��OH��2+O2=2MnO��OH��2��
��2��ˮ���ữ��MnO��OH��2��������������Һ���������������ɵⵥ�ʣ�������Ӧ�����ӷ���ʽ��MnO��OH��2+2I��+4H+=I2+Mn2++3H2O��
���Դ��ǣ�MnO��OH��2+2I��+4H+=I2+Mn2++3H2O��
��3���ڵ���ƿ����ͼ���н��з�Ӧ��Ҫ�����������������ϵ�����ˮ����������Ŀ���ǣ�Һ�⡢��ֹ��ӷ���
���Դ��ǣ�Һ�⡢��ֹ��ӷ���
��4������ˮ���뾭����С���ȴ�����ʹ�ã���Ŀ����ɱ������������������̼��
���Դ��ǣ�ɱ������������������̼��
��5��Na2S2O3��Һ���ȶ���ʹ��ǰ��궨��KIO3������궨Na2S2O3��Һ��Ũ�ȣ���ȡ0.214g KIO3�������KI���ã�KIO3+5KI+6H+=3I2+3H2O�������ĵ���Na2S2O3��Һ�ζ�����ȥ24.00mL��2S2O32��+I2�T2I��+S4O62����
KIO3��3I2�� | 6S2O32�� |
1 | 6 |
|
|
��Na2S2O3��Һ��Ũ��ΪNa2S2O3Ũ��= 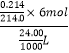 =0.25mol/L��
=0.25mol/L��
���Դ��ǣ�0.25mol/L��
��6��ȡ100.00mL ˮ�����������ữ���ø� Na2S2O3��Һ�ζ����Ե�����Һ��ָʾ�����յ�����Ϊ�����һ�α�Һ����ʱ����Һ����ɫ��Ϊ��ɫ���Ұ�������ޱ仯��2Mn��OH��2+O2=2MnO��OH��2��MnO��OH��2+2I��+4H+=I2+Mn2++3H2O��2S2O32��+I2�T2I��+S4O62����
�õ�
O2��2MnO��OH��2��2I2�� | 4S2O32�� |
1 | 4 |
n | 0.25mol/L��0.01L |
n=0.000625mol��
100mlˮ�����ܽ���������=0.000625mol��32g/mol=0.02g��1Lˮ���ܽ���������0.2g����ˮ�����ܽ����ĺ���Ϊ200mg/L��
���Դ��ǣ������һ�α�Һ����ʱ����Һ����ɫ��Ϊ��ɫ���Ұ�������ޱ仯��200��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�