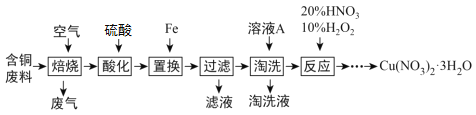
题目内容
【题目】Ⅰ.肼(N2H4)又称联氨,常温时是一种可燃性液体,可用作火箭燃料。
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4=___。(用ΔH1、ΔH2、ΔH3表示)
II.如图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。
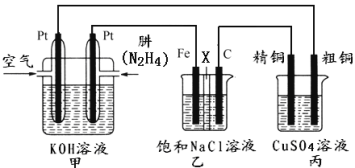
根据要求回答相关问题:
(1)甲装置中通入___气体的一极为正极。
(2)乙装置中石墨电极为___极,其电极反应式为__;可以用__检验该反应产物,电解一段时间后,乙池中的溶液呈__性。
(3)图中用丙装置模拟工业中的___原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为__g。
【答案】ΔH4=2ΔH3-2ΔH2-ΔH1 空气 阳 2Cl--2e-=Cl2↑ 湿润的碘化钾淀粉试纸(或用玻璃棒蘸取浓氨水或湿润的蓝色石蕊试纸或湿润的有色布条等) 碱 粗铜的精炼 0.8
【解析】
Ⅰ.根据盖斯定律分析计算;
II.燃料电池中通入燃料的电极为负极,通入空气的电极为正极,结合原电池原理和电解池原理分析解答。
Ⅰ.①①2O2(g)+N2(g)=N2O4(l) ΔH1,②N2(g)+2H2(g)=N2H4(l) ΔH2,③O2(g)+2H2(g)=2H2O(g) ΔH3,所求反应为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g),根据盖斯定律,由③×2-②-①得到,反应的焓变△H4=2△H2-2△H3-△H1,故答案为:2△H2-2△H3-△H1;
II.(1)甲为燃料电池,通入燃料的电极为负极,通入空气的电极为正极,故答案为:空气;
(2)乙装置中石墨与电源正极相连,为阳极,阳极上发生氧化反应,氯离子失去电子生成氯气,电极反应式为2Cl--2e-=Cl2↑,可以用湿润的淀粉碘化钾试纸,检验氯气,观察试纸是否变蓝,电解食盐水的总反应为2H2O+2Cl-![]() Cl2↑+H2↑+2OH-,因此电解后的溶液呈碱性,故答案为:阳;2Cl--2e-=Cl2↑;湿润的淀粉碘化钾试纸;碱;
Cl2↑+H2↑+2OH-,因此电解后的溶液呈碱性,故答案为:阳;2Cl--2e-=Cl2↑;湿润的淀粉碘化钾试纸;碱;
(3)装置丙中,粗铜作阳极,纯铜作阴极,所以该装置为粗铜精炼装置;原电池负极和纯铜电极上有:N2H4~N2~4e-,Cu~Cu2+~2e-,根据电子守恒得到关系式:N2H4~2Cu,n(N2H4)=![]() n(Cu)=
n(Cu)=![]() ×
×![]() =0.025mol,m(N2H4)=nM=0.025mol×32g/mol=0.8g,故答案为:粗铜的精炼;0.8。
=0.025mol,m(N2H4)=nM=0.025mol×32g/mol=0.8g,故答案为:粗铜的精炼;0.8。