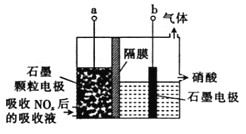
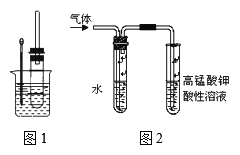
题目内容
【题目】下列框图中的物质均为初中化学常见的物质,其中A是建筑材料的主要成分,B属于氧化物,下图是它们之间的相互转化关系。请回答:
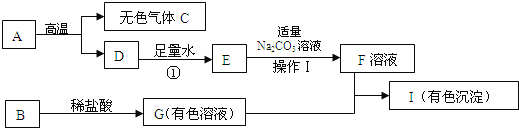
(1)写出物质A的化学式:_____________ ;
(2)得到F溶液的操作Ⅰ的名称为:________________;
(3)若I是红褐色沉淀,请写出下列转化的化学方程式:
B→G:_________________;G + F → I:__________________。
【答案】CaCO3过滤Fe2O3+6HCl=2FeCl3 + 3H2OFeCl3 + 3NaOH = 3NaCl+ Fe(OH)3↓
【解析】
根据A是建筑材料的主要成分,A在高温下又会生成无色气体C和物质D,所以A为碳酸钙,C为二氧化碳,D为氧化钙,氧化钙和水生成氢氧化,E为氢氧化钙,氢氧化钙和碳酸钠生成碳酸钙沉淀和氢氧化钠,所以F为氢氧化钠;若I是红褐色沉淀,则I为Fe(OH)3,G是有色溶液为FeCl3溶液,G是由氧化物B与盐酸反应生成的,所以B为Fe2O3;据以上分析解答。
(1)根据以上分析可知,A是建筑材料的主要成分,A在高温下又会生成无色气体C和物质D,所以A为碳酸钙,C为二氧化碳,D为氧化钙;因此,本题正确答案: CaCO3。
(2)过滤是将不溶性的固体从溶液中分离的一种方法,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠溶液,要得到F溶液,需要过滤;因此,本题正确答案是:过滤。
(3) 根据上述分析可知,若I是红褐色沉淀,则I为Fe(OH)3,它是由G 和F反应产生的,而F为氢氧化钠溶液,因此,G为氯化铁,二者反应生成氢氧化铁红褐色沉淀和氯化钠,反应方程式:FeCl3 +3NaOH =3NaCl+Fe(OH)3↓;G为氯化铁溶液,它是由氧化物B与盐酸反应生成的,所以B为Fe2O3,反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O;正确答案:Fe2O3+6HCl=2FeCl3 + 3H2O;FeCl3 + 3NaOH = 3NaCl+ Fe(OH)3↓。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】将0.2 mol·L-1的KI溶液和0.05 mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和② B. ②和④ C. ③和④ D. ①和③
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。
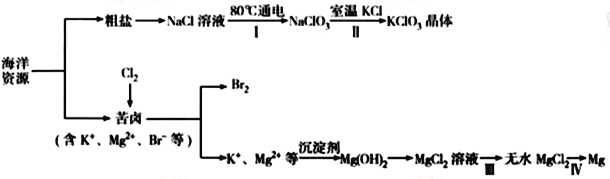
回答下列问题:
(1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,要加入的试剂分别为__________________、__________________。
(2)写出步骤Ⅰ中反应的总化学方程式为___________________________________。
(3)简述步骤Ⅱ中能析出KClO3晶体而无其他晶体析出的原因是_____________________________。
(4)已知MgCl2溶液受热时易水解生成Mg(OH)Cl,写出该过程的化学方程式__________________。
(5)为得到无水MgCl2,步骤Ⅲ的操作应为_____________________________。
(6)步骤Ⅳ中,电解熔融MgCl2得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_____。
A.N2 B.H2 C. CO2 D.空气
(7)海水中溴含量为65mg·L-1。若1L海水中95%溴元素被氧化为Br2经热空气吹出,溴单质残留量3%。最后用SO2将90%Br2还原成Br-,所得溶液体积为50mL。此过程的目的为________________。所得溶液中溴离子浓度为海水中溴离子浓度的_____________倍(精确到0.1)。
【答案】 NaOH 溶液 Na2CO3溶液 Cl-+3H2O![]() ClO3-+3H2↑ 此温度下 KClO3溶解度最小 MgCl2+H2O
ClO3-+3H2↑ 此温度下 KClO3溶解度最小 MgCl2+H2O![]() Mg(OH)Cl+HCl↑ 通入氯化氢,蒸发浓缩冷却结晶 B 提高溴水的浓度 16.6倍
Mg(OH)Cl+HCl↑ 通入氯化氢,蒸发浓缩冷却结晶 B 提高溴水的浓度 16.6倍
【解析】试题分析:(1)除去Mg2+和Ca2+,可以用生成氢氧化镁、碳酸钙沉淀的方法;(2)根据电子守恒,步骤Ⅰ中电解氯化钠溶液,生成氯酸钠、氢气;(3)室温下 KClO3溶解度最小;(4)MgCl2溶液受热时易水解生成Mg(OH)Cl和HCl气体;(5)通入氯化氢可以抑制氯化镁水解;(6)根据金属镁的性质分析;(7)1L海水中95%溴元素转移到50mL溶液中,目的提高溴水的浓度;根据溴元素守恒计算溴离子浓度;
解析:(1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,可以加入氢氧化钠溶液、碳酸钠溶液;(2)根据电子守恒,步骤Ⅰ中电解氯化钠溶液,生成氯酸钠、氢气;反应的总化学方程式为Cl-+3H2O![]() ClO3-+3H2↑;(3)室温下 KClO3溶解度最小,所以向氯酸钠溶液中加入氯化钾能析出KClO3晶体而无其他晶体析出;(4)MgCl2溶液受热时易水解生成Mg(OH)Cl和HCl气体,反应的化学方程式是MgCl2+H2O
ClO3-+3H2↑;(3)室温下 KClO3溶解度最小,所以向氯酸钠溶液中加入氯化钾能析出KClO3晶体而无其他晶体析出;(4)MgCl2溶液受热时易水解生成Mg(OH)Cl和HCl气体,反应的化学方程式是MgCl2+H2O![]() Mg(OH)Cl+HCl↑;(5)通入氯化氢可以抑制氯化镁水解,为得到无水MgCl2,步骤Ⅲ的操作应为通入氯化氢,蒸发浓缩冷却结晶;(6)A.Mg与N2反应生成Mg3N2,故A错误; B.H2与Mg不反应,故B正确; C. CO2与Mg反应生成氧化镁和碳,故C错误; D.镁在空气中能燃烧,故D错误。(7)1L海水中95%溴元素转移到50mL溶液中,目的提高溴水的浓度;设所得溶液中溴离子浓度为x mg·L-1,根据溴元素守恒,
Mg(OH)Cl+HCl↑;(5)通入氯化氢可以抑制氯化镁水解,为得到无水MgCl2,步骤Ⅲ的操作应为通入氯化氢,蒸发浓缩冷却结晶;(6)A.Mg与N2反应生成Mg3N2,故A错误; B.H2与Mg不反应,故B正确; C. CO2与Mg反应生成氧化镁和碳,故C错误; D.镁在空气中能燃烧,故D错误。(7)1L海水中95%溴元素转移到50mL溶液中,目的提高溴水的浓度;设所得溶液中溴离子浓度为x mg·L-1,根据溴元素守恒, ![]() ,x=1078.2,所得溶液中溴离子浓度为海水中溴离子浓度的
,x=1078.2,所得溶液中溴离子浓度为海水中溴离子浓度的![]() 16.6倍;
16.6倍;
【题型】综合题
10
【题目】碳和氯元素及其化合物与人类的生产、生活密切相关。
I、氯的化合物合成、转化一直是科学研究的热点。
(1)一定条件下,氯气与氨气反应可以制备氯胺(NH2Cl)气体,己知部分化学键的键能:
化学键 | N—H | CI—Cl | N—Cl | H—Cl |
键能/ kJmol-1 | 391.3 | 243.0 | 191.0 | 431.8 |
则上述反应的热化学方程式为:__________________。
(2)氯胺(g)是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为______________________。
II.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
(1)在三个容积均为1L的密闭容器中以不同的氢碳比![]() 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示。
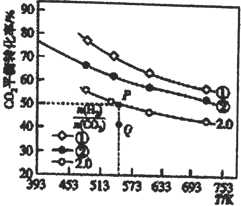
请回答下列问题:
①氢碳比①________②,Q点V(正)___v(逆),该反应的ΔH ________0,(填“大于”或“小于”)
②若起始时,CO2、H2的浓度分别为0.5mol·L-1、l mol·L-1,则P点对应温度的平衡常数的值为_____。P点对应的平衡常数__________Q点对应的平衡常数(填“>”、“<”或“=”)
(2)已知:碳酸H2CO3,K1=4.3×10-7、K2=5.6×10-11
草酸H2C2O4,K1=6.0×10-2、K2=6.0×10-5
①下列微粒可以大量共存的是___________(填字母)。
a.H2CO3、C2O42- b.CO32-、HC2O4- c. C2O42-、HCO3- d.H2C2O4、HCO3-
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外)浓度由大到小的顺序是_________________________________。